题目内容
【题目】石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。回答下列问题:
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H1=-362 kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为__________________。
(2)可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数为_______。(已知H2CO3 的Ka1=4.2×10-7,Ka2=5.6×10-11;H2S的Ka1=5.6×10-8,Ka2=1.2×10-15)
(3)在强酸溶液中用H2O2 可将COS氧化为硫酸,这一原理可用于COS 的脱硫。该反应的化学方程式为_______。
(4)COS的水解反应为COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
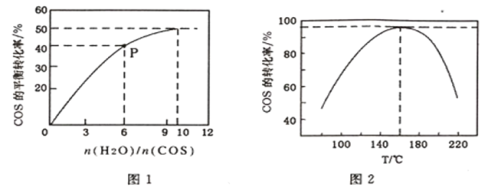
①该反应的最佳条件为:投料比[n(H2O)/n(COS)]__________,温度__________。
②P点对应的平衡常数为_____________ 。(保留小数点后2 位)
【答案】2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=-632kJ·mol-1 1.0×103 COS+4H2O2 =CO2+H2SO4+3H2O 10:1 160℃ 0.05
【解析】
(1) ①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H1=-362 kJ·mol
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
将[①×2+②]/3得:2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=-632kJ·mol-1
答案为:2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=-632kJ·mol-1
(2)可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数为K=![]() 答案为:1.0×103
答案为:1.0×103
(3)在强酸溶液中用H2O2 可将COS氧化为硫酸。该反应的化学方程式为COS+4H2O2 =CO2+H2SO4+3H2O。
答案为:COS+4H2O2 =CO2+H2SO4+3H2O
(4)①从图1中可以看出,投料比[n(H2O)/n(COS)]为10:1时,COS的转化率最高。
答案为 10:1
温度为160℃时,COS的转化率最高。 答案为:160℃
② 在P点,[n(H2O)/n(COS)]=6,COS的转化率为40%
设COS的起始浓度为1mol/L,则H2O(g)的起始浓度为6mol/L
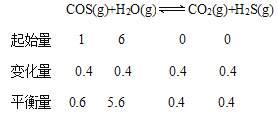
K=![]()
答案为:0.05

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案