题目内容
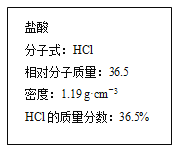
【题目】某些氮的化合物是引起大气污染、水体污染和土壤污染原因之一。
I.汽车和工业废气中的氮氧化物是城市空气污染的主要来源。氮氧化物处理通常有下列途径:
(1)在汽车排气管内安装催化转化器,其反应为2NO(g) +2CO(g)= 2CO2(g) +N2(g)。
①该反应能够正向自发进行,则正反应的ΔH_________0(填“>”或“<”)。
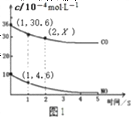
②根据传感器记录某温度下,NO、CO的反应进程,测量所得数据绘制出图1。前1s内平均反应速率v(N2)=__________mol/(L·s);第2s时的X值范围_________________________。
(2)烟气中的氮氧化物(NOx)可与甲烷在一定条件下反应转化为无害成分,从而消除污染。已知
反应 | 反应热(△H/kJ·mol-1) | 平衡常数(K) |
CH4(g)+2O2(g)═CO2(g)+2H2O(l) | a | K1 |
N2(g)+O2(g)═2NO(g) | b | K2 |
则CH4脱硝的热化学方程式为CH4(g) + 4NO (g)![]() CO2(g) + 2N2(g) + 2H2O (l)ΔH=_________kJ/mol(用a、b表示);平衡常数K3=_________(用K1、K2表示)。
CO2(g) + 2N2(g) + 2H2O (l)ΔH=_________kJ/mol(用a、b表示);平衡常数K3=_________(用K1、K2表示)。
II.氰化钠是一种重要的基本化工原料。“天津港”爆炸中,氰化钠产生泄漏,为了避免给土壤和水体带来污染,消防员通过喷洒双氧水来处理泄漏的氰化钠。
(3)已知:NaCN + H2O2+ H2O=NaHCO3+ NH3↑,用H2O2处理1mol NaCN时,反应中转移电子的物质的量为_________mol(NaCN中C为+2价)。
(4)某兴趣小组检测处理后的氰化钠废水是否达标。
已知:①废水中氰化钠的最高排放标准为0.50 mg/L。
②Ag++2CN-= [Ag(CN)2]-,Ag++I-= AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
③实验如下:取30.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000×10-4mol/L的AgNO3标准溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
④滴定终点的判断方法是_________。
⑤经计算处理后的废水中NaCN的浓度为_________mg/L(保留两位小数),处理后的废水是否达到排放标准:________(填“是”或“否”)
III.工业废水中,含有NaNO2。NaNO2固体外观酷似食盐,误食会中毒。可用电解法将废水中少量的![]() 转化为N2以降低其危害。写出
转化为N2以降低其危害。写出![]() 在酸性条件下转化为氮气的电极反应式为_____________。
在酸性条件下转化为氮气的电极反应式为_____________。
【答案】< 2.7×10﹣4 25.2<X<30.6 a﹣2b ![]() 2 滴入最后一滴溶液,出现黄色沉淀,且半分钟内不消失 0.49 能 【答题空10】2NO2-+8H++6e-=N2+4H2O
2 滴入最后一滴溶液,出现黄色沉淀,且半分钟内不消失 0.49 能 【答题空10】2NO2-+8H++6e-=N2+4H2O
【解析】
(1)①反应2NO(g)+2CO(g)2CO2(g)+N2(g)能够自发进行,反应△S<0,若满足△H-T△S<0,必须△H<0,故答案为:<;
②一氧化氮的反应速率为v(CO)=![]() =
=![]() =5.4×10-3mol/(L·s),同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,所以v(N2)=
=5.4×10-3mol/(L·s),同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,所以v(N2)=![]() v(CO)=2.7×10-4mol/(L·s);因为随着反应进行反应速率越来越小,所以第2S消耗的CO小于第1S的36-30.6=5.4,则第2s时的30.6>x>30.6-5.4=25.2,故答案为:2.7×10-4;25.2<X<30.6;
v(CO)=2.7×10-4mol/(L·s);因为随着反应进行反应速率越来越小,所以第2S消耗的CO小于第1S的36-30.6=5.4,则第2s时的30.6>x>30.6-5.4=25.2,故答案为:2.7×10-4;25.2<X<30.6;
(2)①CH4(g)+2O2(g)═CO2(g)+2H2O(l) K1=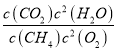 ,△H=akJmol-1;②N2(g)+O2(g)═2NO(g) K2=
,△H=akJmol-1;②N2(g)+O2(g)═2NO(g) K2=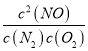 ,△H=bkJmol-1;依据盖斯定律计算,①-②×2得到CH4脱硝的热化学方程式为CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l)△H=(a-2b)kJmol-1;K3=
,△H=bkJmol-1;依据盖斯定律计算,①-②×2得到CH4脱硝的热化学方程式为CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l)△H=(a-2b)kJmol-1;K3= =
=![]() ,故答案为:a-2b;
,故答案为:a-2b;![]() ;
;
(3)NaCN与双氧水反应为:NaCN+H2O2+H2O=NaHCO3+NH3↑,反应中C元素化合价升高,被氧化,O元素化合价降低,被还原,处理1molNaCN,C元素化合价由+2价升高为+4价,则转移2mol电子;故答案为:2;
Ⅱ.④Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,滴入最后一滴硝酸银溶液,Ag+与I-生成AgI黄色沉淀,且半分钟内不消失,说明反应到达滴定终点,故答案为:滴入最后一滴溶液,出现黄色沉淀,且半分钟内不消失;
⑤消耗AgNO3的物质的量为1.5×10-3L×0.0001mol/L=1.50×10-7mol,根据方程式Ag++2CN-=[Ag(CN)2]-,处理的废水中氰化钠的质量为1.50×10-7mol×2×49g/mol=1.47×10-5g,废水中氰化钠的含量为![]() =0.49mg/L<0.50mg/L,处理后的废水达到达到排放标准,能排放,故答案为:0.49;能;
=0.49mg/L<0.50mg/L,处理后的废水达到达到排放标准,能排放,故答案为:0.49;能;
III.电解时,得电子的微粒在阴极上发生还原反应,电解亚硝酸根离子溶液时,阴极上亚硝酸根离子得电子发生还原反应生成氮气和水,电极反应式为2NO2-+8H++6e-=N2↑+4H2O,故答案为:2NO2-+8H++6e-=N2+4H2O。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案【题目】(1)已知在常温常压下:
①CH3OH(l)+ O2(g)=CO(g)+ 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:___________________________ 。
(2)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
CH3OH(g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
容器 | 甲 |
反应物投入量 | 1mol CO2(g)和3mol H2(g) |
平衡时c(CH3OH) | c1 |
平衡时能量变化 | 放出29.4kJ |
若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是_____mol/(L·s)。
(3)铅蓄电池放电时总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。铅蓄电池放电时的正极反应式为____ ,当电路中有0.2mol电子转移时,理论上两电极质量变化的差为_______ g。
(4)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:
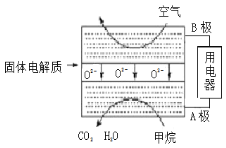
①A极电极反应式为____________________。
②若燃料电池消耗的空气在标准状况下的体积是5.6L(假设空气中O2体积为20%),则理论上消耗甲烷________mol。