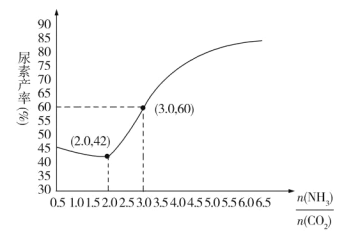
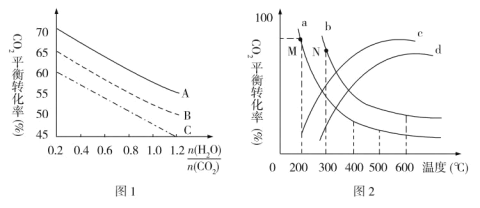
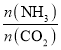【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以实验结果记录如下:
编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
1 | Al、Cu | 稀盐酸 | 偏向Cu |
2 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
回答下列(1)、(2)小题:
⑴实验1中Al作的电极为____(填“正极”或“负极”),Cu作的电极为____(填“正极"或“负极”)。
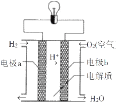
⑵实验2观察到C(石墨)棒上产生的现象是____,负极的电极反应式为____.如图是电解质为稀硫酸溶液的氢氧燃料电池。该电池的电子从电极____经过导线流向电极____(填a或b)