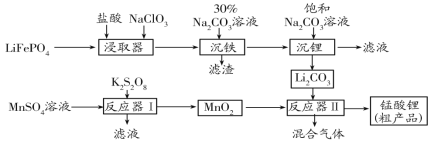
题目内容
【题目】以二氧化碳为原料制备尿素工艺被广泛研究。其反应机理为:
反应Ⅰ:CO2(g)+2NH3(g)NH2COONH4(l) H1=-117.2 kJ·mol1
反应Ⅱ:NH2COONH4(l)NH2CONH2(l)+H2O(l) H2= +15.0 kJ·mol1
(1)反应Ⅰ平衡常数K的表达式为_____________。
(2)由CO2(g)和NH3(g)合成尿素NH2CONH2(l)的热化学方程式是__________。
(3)在恒容容器中按物质的量之比1∶2通入CO2和NH3,下列不能说明合成尿素反应达平衡状态的是_________。
A.容器中气体平均相对分子质量不再变化
B.容器中气体密度不再变化
C.NH3的体积分数不再变化
D.容器内压强不再变化
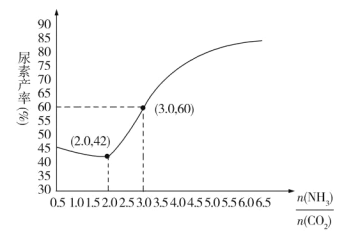
(4)通过实验发现,其他条件不变时,改变NH3、CO2的物质的量之比可增加尿素的产率,如图为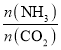 与尿素产率的关系曲线。通过曲线可知:______________过量对尿素产率的影响比较小。若在固定容器中按
与尿素产率的关系曲线。通过曲线可知:______________过量对尿素产率的影响比较小。若在固定容器中按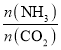 等于3.0通入CO2和NH3,则合成尿素反应达平衡后,混合气体中CO2的物质的量分数为________(精确到0.1%)。
等于3.0通入CO2和NH3,则合成尿素反应达平衡后,混合气体中CO2的物质的量分数为________(精确到0.1%)。
(5)探究发现,温度、压强、n(H2O)条件对合成尿素反应的影响如图1、图2,根据图像回答下列问题:
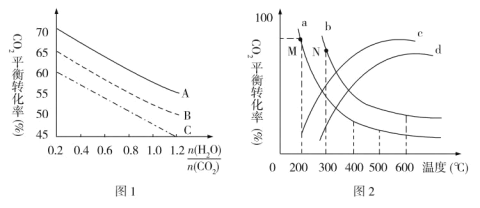
①其他条件不变时,对于合成尿素的反应,若通入CO2物质的量一定,按三种投料比[分别为 3.0、3.5、4.0]投料时,得到如图1的横轴对CO2的平衡转化率的影响曲线。曲线A对应的投料比是________。
②图2中a、b、c、d 四条曲线中的两条代表压强分别为20 MPa、25 MPa时CO2平衡转化率曲线,其中表示20MPa的是_________(填字母)。在实际生产中采用图2中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的主要原因是________。
【答案】K=![]() CO2(g)+2NH3(g)NH2CONH2(l)+H2O(l) ΔH=-102.2 kJ·mol1 AC CO2 18.2% 4.0 a 与300 ℃相比,200 ℃时CO2的平衡转化率更高;虽然压强越大、温度越高反应速率越快,但200 ℃、20 MPa条件下,对设备要求低,有利于降低成本
CO2(g)+2NH3(g)NH2CONH2(l)+H2O(l) ΔH=-102.2 kJ·mol1 AC CO2 18.2% 4.0 a 与300 ℃相比,200 ℃时CO2的平衡转化率更高;虽然压强越大、温度越高反应速率越快,但200 ℃、20 MPa条件下,对设备要求低,有利于降低成本
【解析】
(1)反应中有固体或纯液体参加,则它们的浓度不应写在平衡常数的表达式中,NH2COONH4(l)是纯液体,则反应Ⅰ的平衡常数表达式为K=![]() ;答案为:K=
;答案为:K=![]() ;
;
(2)根据盖斯定律,反应Ⅰ+反应Ⅱ得:CO2(g)+2NH3(g)![]() NH2CONH2(l) +H2O(l) ΔH= H1+H2=-117.2 kJ·mol1+(+15.0 kJ·mol1)=-102.2 kJ·mol1。答案为:CO2(g)+2NH3(g)
NH2CONH2(l) +H2O(l) ΔH= H1+H2=-117.2 kJ·mol1+(+15.0 kJ·mol1)=-102.2 kJ·mol1。答案为:CO2(g)+2NH3(g)![]() NH2CONH2(l) +H2O(l) ΔH=-102.2 kJ·mol1;
NH2CONH2(l) +H2O(l) ΔH=-102.2 kJ·mol1;
(3)A.由于该混合气体反应前后均是CO2和NH3,且体积分数之比恒为1∶2,故容器中气体平均相对分子质量恒定不变,不能说明反应达到平衡;A项错误;
B.容器中气体密度等于气体质量除以容器体积,由于气体总质量在减少,故气体密度不再变化时,反应达到平衡;B项正确;
C.整个反应过程NH3的体积分数恒定为![]() ,故不能说明达到平衡;C项错误;
,故不能说明达到平衡;C项错误;
D.压强与气体总物质的量相关,由于气体总物质的量在变化,故容器内压强不变时,说明反应达到平衡。D项正确;
答案为A、C。
(4)根据曲线可知,CO2过量,尿素产率由42%增加至45%,而NH3过量,尿素产率由42%增加至接近90%,故CO2过量对尿素产率的影响比较小。根据图像知,![]() =3时,尿素产率为60%,可转化为CO2转化率为60%,再利用三段式求解。
=3时,尿素产率为60%,可转化为CO2转化率为60%,再利用三段式求解。
设反应中CO2投入了amol,NH3投入了3amol,则有:
CO2 (g) + 2NH3(g)NH2CONH2(l) + H2O(l)

则混合气体中CO2的物质的量分数为![]() ,答案为:18.2%;
,答案为:18.2%;
(5)①当![]() 一定时,
一定时,![]() 比值越大,即NH3越多,CO2span>转化率越大,故A曲线代表比值为4.0。答案为:4.0;
比值越大,即NH3越多,CO2span>转化率越大,故A曲线代表比值为4.0。答案为:4.0;
②由于合成尿素反应CO2(g)+2NH3(g)NH2CONH2(l)+H2O(l) ΔH=-102.2 kJ·mol1是一个放热反应,因此温度升高,平衡逆向移动,CO2的平衡转化率降低,从曲线a,b中选择。当温度一定,压强增大,平衡正向移动,CO2的平衡转化率增大,故20 MPa条件下的曲线为a。M点条件为200 ℃,20MPa;N点条件为300 ℃,25 MPa。与300℃相比,200℃时CO2的平衡转化率更高;虽然压强越大、温度越高反应速率越快,但200℃、20MPa条件下,对设备要求低,有利于降低成本。答案为:a;与300℃相比,200℃时CO2的平衡转化率更高;虽然压强越大、温度越高反应速率越快,但200℃、20MPa条件下,对设备要求低,有利于降低成本。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】昆明得天独厚的气候地理条件,造就了亚洲第一鲜花交易市场。生活中人们为了延长鲜花的寿命,通常会加入鲜花保鲜剂。
下表是0.25 L某种鲜花保鲜剂中含有的成分及含量(部分成分省略)。回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖(C12H22O11) | 12.50 | 342 |
硫酸钾(K2SO4) | 0.125 | 174 |
高锰酸钾(KMnO4) | 0.125 | 158 |
硝酸银(AgNO3) | 0.01 | 170 |
…… | …… | …… |
(1)鲜花保鲜剂的下列成分中,不属于电解质的是__________(填标号)。
a.C12H22O11 b.K2SO4 c.KMnO4 d.AgNO3
(2)欲配制250 mL该鲜花保鲜剂,现已提供下列仪器:①250mL容量瓶②量筒③烧杯④药匙⑤电子天平,如要完成实验,缺少的玻璃仪器还有_________、_________ (写仪器名称)。
(3)下列操作会使所配鲜花保鲜剂浓度偏低的是__________(填标号)。
a.容量瓶用蒸馏水洗净后没有烘干 b.用玻璃棒引流,将溶液转移到容量瓶中时有溶液洒到了容量瓶外面 c.定容时俯视刻度线 d.滴加蒸馏水,使溶液凹面刚好与刻度线相切,盖上瓶塞反复摇匀后,静置,发现液面比刻度线低,再加水至刻度线
(4)写出该鲜花保鲜剂中K+的物质的量浓度的计算式(省略成分中不含K+)_______(不必化简)。