题目内容
【题目】据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌和镉位于同副族,而锌与铜相邻。现有 4 种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是______(填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是_______。在硫的化合物中,H2S、CS2都是三原子分子,但它们的键角(立体构型)差别很大,用价层电子对互斥理论解释:_________;用杂化轨道理论解释:_________。
(3)Cd2+与NH3等配体形成配离子。[Cd(NH3)4]2+中2个NH3被2个Cl-替代只得到1种结构,它的立体构型是___________。1 mol [Cd(NH3)4]2+含___________mol σ键。
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为__________。
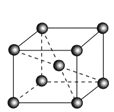
(5)锆晶胞如图所示,1个晶胞含_______个Zr原子;这种堆积方式称为__________。
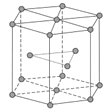
(6)镉晶胞如图所示。已知:NA是阿伏加德罗常数的值,晶体密度为 d g·cm-3。在该晶胞中两个镉原子最近核间距为______nm(用含NA、d的代数式表示),镉晶胞中原子空间利用率为________(用含π的代数式表示)。
【答案】A S原子半径小于Te,H-S键的键能较大 H2S分子中S原子价层有2个孤电子对,孤电子对对成键电子对排斥力大于成键电子对之间排斥力,所以键角较小;CS2分子中C原子价层没有孤电子对,成键电子对之间排斥力相同且较小 H2S中S采用sp3杂化,CS2中C采用sp杂化 正四面体 16 AsBr3>AsCl3>AsF3 6 六方最密堆积 ![]()
![]()
【解析】
(1)电离能大小与原子的外围电子构型有关,具有稳定构型的元素,电离能较大。而同一元素电离能满足:I1<I2<I3<I4。锌原子的第一电离能大于铜原子第一电离能,有①>③;铜的第二电离能大于锌的第二电离能,有④>②。锌的第二电离能大于第一电离能,②>①。故选A。答案为:A;
(2)从原子半径、键能角度分析气态氢化物的热稳定性。原子半径:r(S)<r(Te),键能:H-S>H-Te,所以H2S较稳定。H2S分子中S原子价层有2个孤电子对,孤电子对对成键电子对排斥力大于成键电子对之间排斥力,所以键角较小;CS2分子中C原子价层没有孤电子对,成键电子对之间排斥力相同,呈直线形最稳定,键角较大。从杂化轨道角度解释,H2S中S采用sp3杂化,CS2中C采用sp杂化。答案为:S原子半径小于Te,H–S键的键能较大;H2S分子中S原子价层有2个孤电子对,孤电子对对成键电子对排斥力大于成键电子对之间排斥力,所以键角较小;CS2分子中C原子价层没有孤电子对,成键电子对之间排斥力相同且较小;H2S中S采用sp3杂化,CS2中C采用sp杂化;
(3)[Cd(NH3)4]2+中2个NH3被2个Cl替代只得到1种结构,说明Cd2+采用sp3杂化,呈正四面体结构。配位键也是σ键。1 mol [Cd(NH3)4]2+含16 mol σ键。答案为:正四面体;16;
(4)它们都是分子晶体,相对分子质量越大,范德华力越大,熔点越高。故熔点排序为AsBr3>AsCl3>AsF3。答案为:AsBr3>AsCl3>AsF3;
(5)在六棱柱中,12个原子位于顶点、2个原子位于面心,3个原子位于体内。1个六棱柱含6个原子。这种堆积方式叫六方最密堆积。答案为:6;六方最密堆积;
(6)图2为体心立方堆积,3个镉原子位于体对角线且相切,1个晶胞含2个镉原子。设晶胞参数为a,d=![]() ,a=
,a=![]() nm。设两镉原子最近核间距为x,(2x)2=3a2,x=
nm。设两镉原子最近核间距为x,(2x)2=3a2,x=![]() nm。设镉原子半径为r,则r=
nm。设镉原子半径为r,则r=![]() nm,φ=
nm,φ=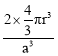 =
=![]() 。答案为:
。答案为:![]() ;
;![]() 。
。

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案