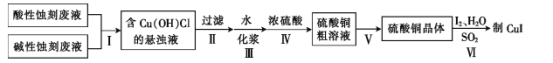
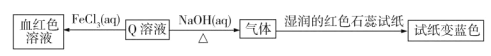
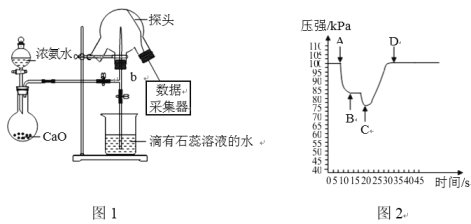
题目内容
【题目】请阅读下列材料,回答下列小题,
人们曾认为N+3H![]() 2NH化学反应速率小,原材料利用率低,不可能用于工业化生产。化学家们不断地研究和改进该反应的条件,如催化制,温度、压强等,并更新设备,成功地开发了合成氨的生产工艺。从此,人类能为植物的生长提供足够的氮肥。道解了地球上有限的耕地资源与庞大的粮食需求之间的矛盾。
2NH化学反应速率小,原材料利用率低,不可能用于工业化生产。化学家们不断地研究和改进该反应的条件,如催化制,温度、压强等,并更新设备,成功地开发了合成氨的生产工艺。从此,人类能为植物的生长提供足够的氮肥。道解了地球上有限的耕地资源与庞大的粮食需求之间的矛盾。
(1)合成氨的反应属于___________
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(2)下列反应条件的改变对反应速率的影响正确的是___________
A.增大N2的浓度能加快反应速率 B.减小H2的浓度能加快反应速率
C.升高温度能减慢反应速率 D.添加催化剂对反应速率无影响
(3)合成氨为放热反应,下列说法正确的是___________
A.断开H-H键放出能量
B.形成N-H键吸收能量
C.反应物的总能量大于生成物的总能量
D.反应物的总能量小于生成物的总能量
【答案】A A C
【解析】
根据各种不同类型反应特点判断反应类型;根据影响反应速率的条件分析判断;化学反应过程就是断裂反应物的化学键吸收能量与形成生成物化学键释放能量的过程分析。
(1)该反应的反应物是两种,生成物是一种,符合化合反应的含义,故合理选项是A;
(2)A.N2是气体反应物,增大反应物N2的浓度,化学反应速率加快,A符合题意;
B.减小气体反应物H2的浓度,化学反应速率减慢,B不符合题意;
C.在其它条件不变时,升高温度能加快化学反应速率,C不符合题意;
D.添加催化剂能加快化学反应速率,D不符合题意;
故合理选项是A;
(3) A.断开H-H键吸收能量,A错误;
B.形成N-H键放出能量,B错误;
C.该反应为放热反应,说明反应物的总能量大于生成物的总能量,C正确;
D.该反应为放热反应,说明反应物的总能量大于生成物的总能量,D错误;
故合理选项是C。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】氯气有毒,且大量制取的难度较大、污染严重,在培养皿中研究氯气的性质可实现“绿色实验”。在培养皿的点滴板中央孔穴中滴加能生成氯气的试剂(如漂粉精与盐酸),然后分别滴加所要进行实验的试剂,如下图。下列是某学生观察到的现象、解释与结论,其中不符合事实的是( )
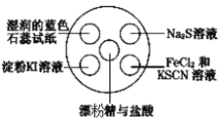
选项 | 实验现象 | 解释 | 结论 |
A | 淀粉 | 氯气置换出 | 氧化性: |
B |
| 氯气置换出 | 非金属性: |
C | 湿润的蓝色石蕊试纸先变红后褪色 | 氯气与水反应生成盐酸和次氯酸 | 氯气具有漂白性 |
D |
|
|
|
A.AB.BC.CD.D