题目内容
19.下列粒子能影响水的电离平衡,且能使水的电离平衡向右移动的是( )| A. | CH3COOH | B. | OH- | C. | Fe3+ | D. |  |
分析 A.醋酸电离得到氢离子,增大了氢离子浓度,水的电离平衡向左移动;
B.增大OH-的浓度,水的电离平衡向左移动;
C.Fe3+与OH-发生反应,降低了OH-的浓度;
D.该离子为Cl-,对水的电离平衡没有影响.
解答 解:A.醋酸电离得到氢离子,增大了氢离子浓度,水的电离平衡向左移动,故A错误;
B.增大OH-的浓度,水的电离平衡向左移动,故B错误;
C.Fe3+与OH-发生反应,降低了OH-的浓度,水的电离平衡向右移动,故C正确;
D.该离子为Cl-,对水的电离平衡没有影响,故D错误;
故选C.
点评 本题考查了水的电离及其影响因素,题目难度不大,注意明确影响水的电离平衡的因素.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | 摩尔是一种国际基本物理量 | |
| B. | 1 mol氢的质量为1g | |
| C. | 在同温同压下,相同体积的任何气体单质所含分子数相同 | |
| D. | 标准状况下气体摩尔体积约为22.4 L |
7.室温下,某溶液中由水电离出来的H+和OH-物质的量浓度的乘积为10-24(mol/L)2,下列说法正确的是( )
| A. | HCO3-一定不能大量存在于该溶液中 | |
| B. | NH4+一定不能大量存在于该溶液中 | |
| C. | 该溶液的pH一定为12 | |
| D. | 该溶液中c(H+)=c(OH-) |
14.下列化学反应的离子方程式正确的是( )
| A. | 碳酸钙与醋酸溶液反应:CaCO3+2H +═Ca2++CO2↑+H2O | |
| B. | 澄清石灰水和盐酸反应:OH-+H+═H2O | |
| C. | 用Na2O2溶于水:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 偏铝酸钠溶液通入过量CO2:AlO2-+4CO2+2 H2O═Al3++4 HCO3- |
4.25℃,某溶液中水电离出的c(H+)=10-5mol/L,则该溶液可能是下列情况中的( )
| A. | 该溶液是盐溶液 | |
| B. | 该溶液可能是酸或碱溶 | |
| C. | 该溶液中c(OH-)=10-5mol/L | |
| D. | 该溶液与pH=9的氢氧化钠等体积混合,混合后溶液可能呈中性 |
11.下列有关金属腐蚀与防护的说法正确的是( )
| A. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| B. | 可将地下输油钢管与外加直流电的正极相连以保护它不受腐蚀 | |
| C. | 自然界中钢铁的腐蚀以析氢腐蚀为主 | |
| D. | 生铁在海水中的腐蚀速度比在空气中快 |
9.(一)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的两种工艺流程如下:
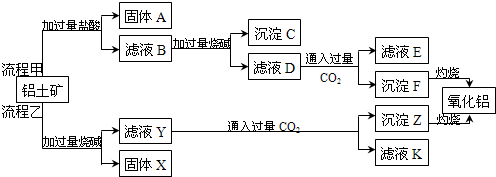
已知:
生成氢氧化物沉淀的pH
请回答下列问题
(1)固体A的主要化学成分是:SiO2(填化学式),
(2)流程乙加入烧碱后生成AlO2-的离子方程式为:Al2O3+2OH-=2AlO2-+H2O
(3)验证滤液B中含有Fe3+的实验操作为:取少量滤液B于试管中,滴加1-2滴硫氰化钾溶液,若溶液变为血红色,则说明滤液B中含有Fe3+
(4)不管是流程甲还是流程乙,都会对铝土矿进行粉碎,原因是:增大固液接触面积,加快反应速率
(5)滤液B也可以通过控制溶液的pH加入氢氧化钠直接得到沉淀F,应调节pH范围为3.2≤pH<3.4.
(二)有机化学
(6)新戊烷的系统命名法命名为:2,3-二甲基丙烷.
(7)按照官能团的分类,有机物 的类别是:酚.
的类别是:酚.
(8)乙酸的核磁共振氢谱图有2个吸收峰,面积比为:1:3或3:1.

已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)固体A的主要化学成分是:SiO2(填化学式),
(2)流程乙加入烧碱后生成AlO2-的离子方程式为:Al2O3+2OH-=2AlO2-+H2O
(3)验证滤液B中含有Fe3+的实验操作为:取少量滤液B于试管中,滴加1-2滴硫氰化钾溶液,若溶液变为血红色,则说明滤液B中含有Fe3+
(4)不管是流程甲还是流程乙,都会对铝土矿进行粉碎,原因是:增大固液接触面积,加快反应速率
(5)滤液B也可以通过控制溶液的pH加入氢氧化钠直接得到沉淀F,应调节pH范围为3.2≤pH<3.4.
(二)有机化学
(6)新戊烷的系统命名法命名为:2,3-二甲基丙烷.
(7)按照官能团的分类,有机物
 的类别是:酚.
的类别是:酚.(8)乙酸的核磁共振氢谱图有2个吸收峰,面积比为:1:3或3:1.