题目内容
10.下列说法正确的是( )| A. | 摩尔是一种国际基本物理量 | |
| B. | 1 mol氢的质量为1g | |
| C. | 在同温同压下,相同体积的任何气体单质所含分子数相同 | |
| D. | 标准状况下气体摩尔体积约为22.4 L |
分析 A.摩尔是物质的量的单位;
B.1mol氢指代不明;
C.根据阿伏伽德罗定律分析;
D.气体摩尔体积的单位是L/mol.
解答 解:A.摩尔是物质的量的单位,是国际单位制中7个基本单位之一,故A错误;
B.1mol氢指代不明,存在歧义,故B错误;
C.同温同压下,相同体积的任何气体含有相同的分子数,称为阿伏加德罗定律,故C正确;
D.标准状况下气体摩尔体积约为22.4 L/mol,故D错误;
故选C.
点评 本题考查了物质的量的单位摩尔,阿伏伽德罗定律和气体摩尔体积,难度不大,难点在于掌握阿伏伽德罗定律的内容和推论.

练习册系列答案
相关题目
16.Na、Cu、O、Si、S、Cl是常见的六种元素.
(1)S的基态原子核外有2个未成对电子;Cu的基态核外电子排布式为1s22s22p63s23p63d104s1.
(2)选填“>”或“<”:
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体.在25℃、101kPa下,已知该反应每消耗1mol CuCl(s),放出热量44.4kJ,该反应的热化学方程式是4CuCl(s)+O2(g)=2CuO(s)+2CuCl2(s)△H=-177.6kJ/mol.
(1)S的基态原子核外有2个未成对电子;Cu的基态核外电子排布式为1s22s22p63s23p63d104s1.
(2)选填“>”或“<”:
| 离子半径 | 酸性 |
| Na+< O2- | H2SO4<HClO4 |
1.下列反应中,不能形成原电池反应的是( )
| A. | 氢氧化钠与盐酸反应 | B. | 金属锌与稀硫酸反应 | ||
| C. | 甲烷燃烧 | D. | 金属铜溶于氯化铁溶液 |
18.下列关于物质的检验说法不正确的是( )
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定含有SO42- | |
| B. | 观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察 | |
| C. | 待检液加入NaOH 溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ | |
| D. | 取少量久置的Na2SO3 样品于试管中加水溶解,再加入足量盐酸有气体产生,然后加入BaCl2 溶液有白色沉淀产生,说明Na2SO3 样品已部分被氧化 |
5.由几种离子化合物组成的混合物,含有以下离子中的若干种:Na+、Cl-、NH4+、Ca2+、Cu2+、CO32-、Ba2+、SO42-.将该混合物溶于水后得无色澄清溶液,现取3份100mL该溶液分别进行如下实验:
试回答下列问题:
(1)根据实验1~3判断混合物中一定不存在的离子是Cu2+、Ba2+、Ca2+.
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
(3)Cl-是否存在?一定存在(填“一定存在”“一定不存在”或“不能确定”),假设存在如何实验验证取少量溶液于试管中,加入足量的Ba(NO3)2,沉淀完全后,静置取上层清液,滴加HNO3酸化的AgNO3,有白色沉淀产生,说明有Cl-.
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体2.24L(已折算成标准状况) |
| 3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
(1)根据实验1~3判断混合物中一定不存在的离子是Cu2+、Ba2+、Ca2+.
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 | 物质的量浓度(mol/L) |
2.铅蓄电池的电压稳定,使用方便,安全可靠,在生活中使用广泛,其中汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2(s)+Pb(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l),根据此反应判断下列叙述中正确的是( )
| A. | PbO2是电池的负极 | B. | 负极的电极反应式为:Pb-2e-=Pb2+ | ||
| C. | Pb得电子,发生氧化反应 | D. | 电池充电时,溶液酸性增强 |
19.下列粒子能影响水的电离平衡,且能使水的电离平衡向右移动的是( )
| A. | CH3COOH | B. | OH- | C. | Fe3+ | D. |  |
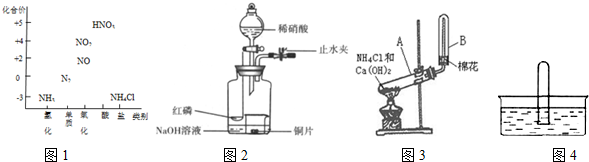

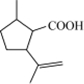 .
.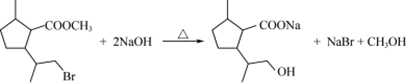 .
.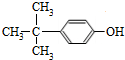 .
.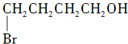 制备
制备  的合成路线图(无机试剂任选).合成路线流程图示例如下:CH2═CH2 $\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH.
的合成路线图(无机试剂任选).合成路线流程图示例如下:CH2═CH2 $\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH.