题目内容
4.25℃,某溶液中水电离出的c(H+)=10-5mol/L,则该溶液可能是下列情况中的( )| A. | 该溶液是盐溶液 | |
| B. | 该溶液可能是酸或碱溶 | |
| C. | 该溶液中c(OH-)=10-5mol/L | |
| D. | 该溶液与pH=9的氢氧化钠等体积混合,混合后溶液可能呈中性 |
分析 酸或碱抑制水电离,含有弱离子的盐促进水电离,25℃,某溶液中水电离出的c(H+)=10-5mol/L>10-7mol/L,说明该溶液中溶质促进水电离,则溶质为含有弱离子的盐,据此分析解答.
解答 解:A.25℃,某溶液中水电离出的c(H+)=10-5mol/L>10-7mol/L,说明该溶液中溶质促进水电离,则溶质为含有弱离子的盐,所以该溶液是盐溶液,故A正确;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离,该溶液促进水电离,则溶质不可能是酸或碱,故B错误;
C.该溶液如果呈酸性,则c(OH-)=10-9mol/L,如果溶液呈碱性,则c(OH-)=10-5mol/L,故C错误;
D.如果该溶质是酸性溶液,溶液中c(H+)=10-5mol/L,盐的水解程度较小,该溶液与pH=9的氢氧化钠等体积混合,反应过程中促进盐水解,所以混合后溶液可能呈酸性,故D错误;
故选A.
点评 本题考查以水的电离为载体考查溶液中溶质及其性质,为高频考点,明确溶质对水电离影响原理是解本题关键,注意溶液中c(H+)与水电离出c(H+)的关系,易错选项是D.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
14.可逆反应FeCl3+3KSCN?Fe(SCN)3+3KCl达到化学平衡后,加人少量的水,平衡的移动情况为( )
| A. | 不移动 | B. | 平衡左移 | C. | 平衡右移 | D. | 无法确定 |
12.下列各反应的产物与反应物用量无关的是( )
| A. | Na2CO3和稀盐酸 | B. | Al2O3和NaOH溶液 | ||
| C. | NH4HCO3和NaOH溶液 | D. | CO2和NaOH溶液 |
19.下列粒子能影响水的电离平衡,且能使水的电离平衡向右移动的是( )
| A. | CH3COOH | B. | OH- | C. | Fe3+ | D. |  |
9.某化学反应过程如图所示,由图得出的判断,正确的是( )
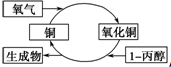

| A. | 反应中有红黑颜色交替变化的现象 | B. | 1-丙醇发生了还原反应 | ||
| C. | 生成物是丙醛和丙酮 | D. | 醇类都能发生图示的催化氧化反应 |
13.下列离子方程式的书写与所给的前提条件不相吻合的是( )
| A. | 将4 molCl2通入到含4 mol FeBr2的溶液中:2Cl2+2Fe2++2Br-=4Cl-+Br2+2Fe3+ | |
| B. | 已知亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)要大.将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:2AlO2-+SO2+3 H2O=2 Al(OH)3↓+SO32- | |
| C. | 稀氨水吸收了少量的二氧化碳气体:2NH3•H2O+CO2=2NH4++H2O+CO32- | |
| D. | 在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大时发生的离子反应是:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ |
14.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4 L CCl4含有4nA个Cl原子 | |
| B. | 常温常压下,18 g H2O中含有2nA个氢原子 | |
| C. | 0.1 mol•L-1NaCl溶液中含有0.1nA个Na+ | |
| D. | 7.8 g Na2O2与足量水反应转移0.2nA个电子 |
 CH3COOC2H5+H2O、酯化反应(取代反应).
CH3COOC2H5+H2O、酯化反应(取代反应).