题目内容
7.室温下,某溶液中由水电离出来的H+和OH-物质的量浓度的乘积为10-24(mol/L)2,下列说法正确的是( )| A. | HCO3-一定不能大量存在于该溶液中 | |
| B. | NH4+一定不能大量存在于该溶液中 | |
| C. | 该溶液的pH一定为12 | |
| D. | 该溶液中c(H+)=c(OH-) |
分析 室温下,水的离子积为10-14,由水电离生成的H+和OH-的物质的量浓度的乘积为10-24,即c(H+)•c(OH-)=10-24,所以水电离的c(H+)=c(OH-)=10-12,溶液显示酸性或者碱性,据此进行判断.
解答 解:室温下,水的离子积为10-14,由水电离生成的H+和OH-的物质的量浓度的乘积为10-24,即c(H+)•c(OH-)=10-24,所以水电离的c(H+)=c(OH-)=10-12,溶液显示酸性或者碱性,
A.HCO3-与酸碱均能反应,所以HCO3-一定不能大量存在于该溶液中,故A正确;
B.若该溶液显酸性,则NH4+能大量存在于该溶液中,故B错误;
C.若该溶液显酸性,则pH<7,故C错误;
D.该溶液显示酸性或者碱性,所以溶液中[H+]≠[OH-],故D错误.
故选A.
点评 本题考查了溶液中离子浓度的计算、离子共存,题目难度不大,注意把握溶液中水电离出来的H+和OH-物质的量浓度相同.

练习册系列答案
相关题目
13.钾钠合金是原子反应堆的冷却剂.已知:
(1)钾钠合金的硬度比其纯金属小(填“大”或“小”),熔点比其纯金属低(填“高”或“低”).
(2)钾钠合金能作为冷却剂是因为钾钠合金具有良好的导热性(填“导电性”或“导热性”).
(3)制备钾钠合金是在氩气气氛里将这两种固体摇晃,固体逐渐融化,氩气的作用是隔绝空气,防止金属钠和金属钾和空气成分反应.
(4)钾钠合金在反应堆中作冷却剂时,必须密封在真空管里,若遇水则会剧烈反应,合金与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑,2K+2H2O=2KOH+H2↑.
| 钠 | 钾 | 钠钾合金(质量比1:3) | |
| 熔点/℃ | 97.9 | 63.5 | <-10 |
(2)钾钠合金能作为冷却剂是因为钾钠合金具有良好的导热性(填“导电性”或“导热性”).
(3)制备钾钠合金是在氩气气氛里将这两种固体摇晃,固体逐渐融化,氩气的作用是隔绝空气,防止金属钠和金属钾和空气成分反应.
(4)钾钠合金在反应堆中作冷却剂时,必须密封在真空管里,若遇水则会剧烈反应,合金与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑,2K+2H2O=2KOH+H2↑.
18.下列关于物质的检验说法不正确的是( )
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定含有SO42- | |
| B. | 观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察 | |
| C. | 待检液加入NaOH 溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ | |
| D. | 取少量久置的Na2SO3 样品于试管中加水溶解,再加入足量盐酸有气体产生,然后加入BaCl2 溶液有白色沉淀产生,说明Na2SO3 样品已部分被氧化 |
2.铅蓄电池的电压稳定,使用方便,安全可靠,在生活中使用广泛,其中汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2(s)+Pb(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l),根据此反应判断下列叙述中正确的是( )
| A. | PbO2是电池的负极 | B. | 负极的电极反应式为:Pb-2e-=Pb2+ | ||
| C. | Pb得电子,发生氧化反应 | D. | 电池充电时,溶液酸性增强 |
12.下列各反应的产物与反应物用量无关的是( )
| A. | Na2CO3和稀盐酸 | B. | Al2O3和NaOH溶液 | ||
| C. | NH4HCO3和NaOH溶液 | D. | CO2和NaOH溶液 |
19.下列粒子能影响水的电离平衡,且能使水的电离平衡向右移动的是( )
| A. | CH3COOH | B. | OH- | C. | Fe3+ | D. | 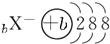 |
17.下列物质中,属于单质的是 ( )
| A. | HCl | B. | CO2 | C. | Br2 | D. | NaOH |
 CH3COOC2H5+H2O、酯化反应(取代反应).
CH3COOC2H5+H2O、酯化反应(取代反应).