题目内容
6.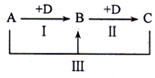 A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).(1)若A为强碱溶液,其焰色反应显黄色,C常用作食品添加剂,请回答下列问题:
①物质的量浓度相同的B、C水溶液的pH前者大于(填大于或小于)后者.
②反应Ⅲ的离子方程式是HCO3-+OH-=H2O+CO32-.
③现有B和C的固体混合物ag,加热至质量不再改变时剩余固体为bg,则B的质量分数为$\frac{84b-53a}{31a}$×100%.
(2)若C、D均为金属单质,向A溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则:①反应 III的离子方程式是2Fe3++Fe=3Fe2+.
②实验室中储存B溶液时应加入铁与盐酸.
③检验溶液A中金属阳离子的方法是取少量溶液于试管中,滴入KSCN溶液,溶液呈血红色.
(3)若D为强电解质、B为难溶于水的沉淀,
①则A和C反应的离子方程式Al3++3AlO2-+6H2O=4Al(OH)3↓
②符合条件的D物质可能是下列物质中的ac(填序号).
a.硫酸 b.醋酸 c.氢氧化钠 d.氨水 e.氯化钡 f.硝酸镁.
分析 (1)若A为强碱,其焰色反应显黄色,应为NaOH,C常用作食品添加剂,结合转化关系可知B为Na2CO3,C为NaHCO3,D为CO2;
(2)向A溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,说明A中含有Cl-,连续加入D可置换出金属单质,说明A中含有的金属元素为变价金属,应为Fe,则A为FeCl3,B为FeCl2,C为Fe,D为活泼性比Fe强的金属;
(3)B为难溶于水的沉淀时应为Al(OH)3,A为Al3+,C为AlO2-,氢氧化铝既能与强酸反应,也能与强碱反应,具有两性.
解答 解:(1)若A为强碱,其焰色反应显黄色,应为NaOH,C常用作食品添加剂,结合转化关系可知B为Na2CO3,C为NaHCO3,D为CO2,
①物质的量浓度相同的B、C水溶液,碳酸钠溶液中碳酸根离子水解程度大于碳酸氢根离子,得到溶液的pH碳酸钠溶液大,故答案为:大于;
②反应Ⅲ为NaHCO3和NaOH的反应,反应的离子方程式是HCO3-+OH-=H2O+CO32-,故答案为:HCO3-+OH-=H2O+CO32-;
③B为Na2CO3,C为NaHCO3,现有B和C的固体混合物ag,加热至质量不再改变时剩余固体为bg,混合物中碳酸氢钠分解产生的水和二氧化碳的质量为(a-b)g,根据关系2NaHCO3~H2O+CO2,可求得混合物中NaHCO3的质量为 $\frac{84×2(a-b)}{62}$=$\frac{84}{31}$(a-b)g,Na2CO3的质量为ag-$\frac{84}{31}$(a-b)g,所以Na2CO3的质量数为$\frac{ag-\frac{84}{31}(a-b)g}{ag}$×100%=$\frac{84b-53a}{31a}$×100%,
故答案为:$\frac{84b-53a}{31a}$×100%;
(2)向A溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,说明A中含有Cl-,连续加入D可置换出金属单质,说明A中含有的金属元素为变价金属,应为Fe,则A为FeCl3,B为FeCl2,C为Fe,D为活泼性比Fe强的金属,
①反应 III是铁离子和铁反应生成亚铁离子,反应的离子方程式是:2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
②由于FeCl2具有还原性且易水解,保存时应加入盐酸抑制水解,加入铁粉防止氧化,
故答案为:铁与盐酸;
③检验FeCl3溶液中含有铁离子的方法是:取少量溶液于试管中,向溶液中滴加少量KSCN溶液,溶液呈血红色,
故答案为:取少量溶液于试管中,滴入KSCN溶液,溶液呈血红色;
(3)①若D为强电解质、B为难溶于水的沉淀,难溶于水的沉淀时应为Al(OH)3,A为Al3+,C为AlO2-,A和C反应的离子方程式是Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
②Al(OH)3既能与强酸反应,也能与强碱反应,则D可为硫酸或NaOH,
故答案为:ac.
点评 本题考查无机物推断,焰色反应及物质的颜色是推断突破口,熟练掌握中学常见连续反应,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | v(W)=v(Z) | B. | 2v(X)=3v(Z) | C. | v(X)=2v(Y) | D. | 3v(W)=2v(X) |
| A. | 电解质溶液导电的过程实际上就是电解的过程 | |
| B. | 利用电解饱和食盐水所得的产物可以生产盐酸 | |
| C. | 铜在酸性环境中易发生析氢腐蚀 | |
| D. | 利用下面反应H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0,不可以设计成原电池装置 |
| A. | 标准状况下,2.24 L NO2溶于水完全反应转移电子数为0.2NA | |
| B. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| C. | 氢原子数为0.6NA的乙烯分子中含有的π键数为0.2NA | |
| D. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA |
湿法制备的主要反应方程为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2═2Na2FeO4+2Na2SO4
下列有关说法不正确的是( )
| A. | 高铁酸钾中铁显+3价 | |
| B. | 湿法中每生成1mol Na2FeO4转移3 mol电子 | |
| C. | 干法中每生成1mol Na2FeO4转移4 mol电子 | |
| D. | K2FeO4处理水时,不仅能消毒杀菌,还能吸附水中的悬浮杂质 |
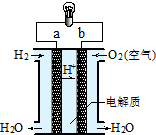
| A. | b极是正极 | |
| B. | 负极的电极反应式为:O2+2H2O+4e-=4OH- | |
| C. | 电子由a通过灯泡流向b | |
| D. | 氢氧燃料电池是环保电池 |
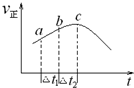 (1)NO2与SO2混合可发生反应:SO2(g)+NO2(g)═SO3(g)+NO(g);①将一定量的NO2与SO2置于绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的趋势如图所示.由图可知下列说法正确的是C(填字母).
(1)NO2与SO2混合可发生反应:SO2(g)+NO2(g)═SO3(g)+NO(g);①将一定量的NO2与SO2置于绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的趋势如图所示.由图可知下列说法正确的是C(填字母).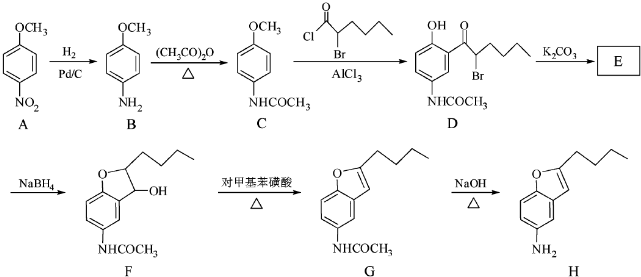
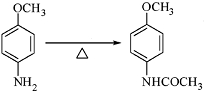 +CH3COOH
+CH3COOH .
.