题目内容
1.下列说法不正确的是( )| A. | 电解质溶液导电的过程实际上就是电解的过程 | |
| B. | 利用电解饱和食盐水所得的产物可以生产盐酸 | |
| C. | 铜在酸性环境中易发生析氢腐蚀 | |
| D. | 利用下面反应H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0,不可以设计成原电池装置 |
分析 A.电解质溶液的导电过程是电解质溶液在外加直流电源作用下电解的过程;
B.电解饱和食盐水可得到氢气和氯气,二者反应生成HCl;
C.Cu与氢离子不反应;
D.自发的氧化反应可以设计成原电池.
解答 解:A.电解质溶液的导电过程是电解质溶液在外加直流电源作用下电解的过程,所以电解质溶液导电的过程实际上就是电解的过程,故A正确;
B.电解饱和食盐水可得到氢气和氯气,二者反应生成HCl,溶于水制得盐酸,故B正确;
C.Cu与氢离子不反应,所以Cu不能发生析氢腐蚀,故C错误;
D.H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0不是氧化还原反应,所以不能设计成原电池装置,故D正确;
故选C.
点评 本题考查了电化学方面的知识,涉及电解池和原电池原理,题目难度不大,要注重对基础知识的积累和运用,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.两种气态烃的混合气体共0.5mol,在空气中完全燃烧生成标准状况下CO216.8L和18g水,关于该混合气体的说法正确的是( )
①一定有CH4②一定有C2H4③一定没有C2H6④可能有C2H4⑤可能有C3H4.
①一定有CH4②一定有C2H4③一定没有C2H6④可能有C2H4⑤可能有C3H4.
| A. | ①③④ | B. | ①②④⑤ | C. | ①④⑤ | D. | ①③④⑤ |
12.海水资源的利用具有广阔前景.海水中主要离子的含量如下表所示.
利用海水可以提取溴和镁,提取过程如下.
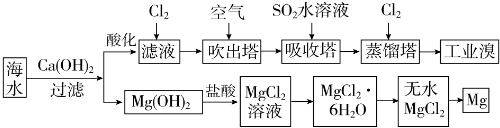
(1)提取溴的过程中,经过两次Br-→Br2转化的目的是:①对溴元素进行富集,
吸收塔中发生反应的离子方程式是:②SO2+Br2+2H2O═4H++2Br-+SO4 2-.
用平衡移动原理解释通空气的目的:③通入空气将溴蒸气带出,使Br2(g)?Br2(aq)(或Br2+H2O?HBr+HBrO)平衡向左移动.
(2)吸收塔中也可采用纯碱吸收Br2,主要反应如下,请配平并表示出电子转移的方向和数目:
□Br2+□Na2CO3+□H2O→□NaBr+□NaBrO3+□NaHCO3
(3)从MgCl2溶液中得到MgCl2•6H2O晶体的主要操作是①加热浓缩、冷却结晶、过滤、洗涤、干燥.最后一步冶炼得到金属镁的化学方程式为②MgCl2(熔融) $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;冶炼时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式③Mg+2H2O $\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
(4)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2的溶解).
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO4 2- | 2560 | Br- | 64 |
| Mg2+ | 1272 |

(1)提取溴的过程中,经过两次Br-→Br2转化的目的是:①对溴元素进行富集,
吸收塔中发生反应的离子方程式是:②SO2+Br2+2H2O═4H++2Br-+SO4 2-.
用平衡移动原理解释通空气的目的:③通入空气将溴蒸气带出,使Br2(g)?Br2(aq)(或Br2+H2O?HBr+HBrO)平衡向左移动.
(2)吸收塔中也可采用纯碱吸收Br2,主要反应如下,请配平并表示出电子转移的方向和数目:
□Br2+□Na2CO3+□H2O→□NaBr+□NaBrO3+□NaHCO3
(3)从MgCl2溶液中得到MgCl2•6H2O晶体的主要操作是①加热浓缩、冷却结晶、过滤、洗涤、干燥.最后一步冶炼得到金属镁的化学方程式为②MgCl2(熔融) $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;冶炼时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式③Mg+2H2O $\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
(4)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2的溶解).
9.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| B. | 1mol (NH4)2Fe(SO4)2•6H2O晶体中含有离子总数为5NA | |
| C. | 常温常压下,2.24 L SO2和O2的混合气体中含有的氧原子总数为0.2 NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中含的CO32-和HCO3-总数为0.1NA |
16.设NA表示阿伏加德罗常数的数值,下列说法中错误的是( )
| A. | 32 g O2所含的分子数目为NA | |
| B. | 1 mol H2O含有的H2O分子数目为NA | |
| C. | 1 mol H2O含有的氢原子数目为NA | |
| D. | 0.5NA个O2分子的物质的量是0.5 mol |
13.500多年前,一艘载着天然苏打晶体的商船在航行中搁浅,船员们便在附近的沙滩上用几块苏打晶体支锅煮饭.之后他们惊奇地发现,锅下苏打与沙粒接触处出现了许多晶莹发亮的珠子.请你们分析一下,这种珠子可能是( )
| A. | 水晶颗粒 | B. | 无水碳酸钠 | C. | 玻璃珠 | D. | 晶体硅 |
10.用VSEPR模型预测下列分子或离子的立体结构,其中正确的是( )
| A. | SO2直线形 | B. | CO2平面三角形 | C. | BCl3三角锥形 | D. | CH4正四面体形 |
11.下列说法正确的是( )
| A. | 淀粉、油脂、蛋白质都能发生水解反应 | |
| B. | 蔗糖溶液中加入新制Cu(OH)2煮沸会析出砖红色沉淀 | |
| C. | 纤维素、淀粉都可用(C6H10O5)n表示,它们互为同分异构体 | |
| D. | 人体各种组织的蛋白质不断分解,最终生成二氧化碳和水,排出体外 |
 A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).