题目内容
18.在一定条件下,RO3n- 和氯气可发生如下反应:RO3n-+Cl2+2OH-═RO42-+2Cl-+H2O由以上反应可知在上过程中RO3n-被氧化(填“氧化”或“还原”),RO3n-中元素R化合价是+4.分析 由电荷守恒可知n=2,R元素化合价由+4价升高到+6价,被氧化,由此分析解答.
解答 解:在离子反应RO3n-+Cl2+2OH-═RO42-+2Cl-+H2O中,由电荷守恒可知n=2,R元素化合价由+4价升高到+6价,被氧化,故答案为:氧化;+4.
点评 本题考查氧化还原反应计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型,把握反应中元素的化合价变化为解答的关键,题目难度不大.

练习册系列答案
相关题目
20.在2A+B?3C+4D反应中,表示该反应速率最快的是( )
| A. | VA═0.5mol L-1S-1 | B. | VB═0.3mol L-1S-1 | ||
| C. | VC═4.8mol L-1min-1 | D. | VD═1mol L-1S-1 |
9.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| B. | 1mol (NH4)2Fe(SO4)2•6H2O晶体中含有离子总数为5NA | |
| C. | 常温常压下,2.24 L SO2和O2的混合气体中含有的氧原子总数为0.2 NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中含的CO32-和HCO3-总数为0.1NA |
13.500多年前,一艘载着天然苏打晶体的商船在航行中搁浅,船员们便在附近的沙滩上用几块苏打晶体支锅煮饭.之后他们惊奇地发现,锅下苏打与沙粒接触处出现了许多晶莹发亮的珠子.请你们分析一下,这种珠子可能是( )
| A. | 水晶颗粒 | B. | 无水碳酸钠 | C. | 玻璃珠 | D. | 晶体硅 |
10.用VSEPR模型预测下列分子或离子的立体结构,其中正确的是( )
| A. | SO2直线形 | B. | CO2平面三角形 | C. | BCl3三角锥形 | D. | CH4正四面体形 |
7.在100ml 混合酸中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L 和0.1mol/L,向该混合液中加1.92g 铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度是( )
| A. | 0.15 mol/L | B. | 0.225 mol/L | C. | 0.35 mol/L | D. | 0.45 mol/L |
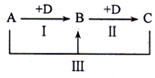 A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).