题目内容
16.按要求回答下列问题:(1)Na2CO3固体中混存少量NaHCO3固体,除杂的方法是加热,有关反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(2)有人用洁厕灵(含HCl)清洗卫生间,再用84消毒液(含NaClO)进行杀菌,结果发生了中毒.请写出涉及反应的离子方程式:Cl-+ClO-+2H+═Cl2↑+H2O.
(3)为检验食盐中是否含有碘元素,某同学查阅资料,利用如下反应进行检验:KIO3+5KI+3H2SO4═3I2+3H2O+3K2SO4,该反应中氧化剂是KIO3,如果生成38.1gI2,则反应过程中转移电子的物质的量为0.25mol.
分析 (1)碳酸氢钠加热分解生成碳酸钠;
(2)二者发生氧化还原反应生成氯气;
(3)KIO3+5KI+3H2SO4═3I2+3H2O+3K2SO4中I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,该反应转移5e-.
解答 解:(1)Na2CO3固体中混有少量NaHCO3杂质,除去杂质的方法是固体加热分解,发生的反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:加热;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)有人用洁厕灵(含HCl)清洗卫生间,再用84消毒液(含NaClO)进行杀菌,二者发生氧化反应生成氯气,结果发生了中毒,反应的离子方程式为Cl-+ClO-+2H+═Cl2↑+H2O,
故答案为:Cl-+ClO-+2H+═Cl2↑+H2O;
(3)KIO3中I元素的化合价由+5价降低为0,则氧化剂为KIO3,由反应可知生成3mol碘转移5mol电子,则如果生成38.1gI2,则反应过程中转移电子的物质的量为$\frac{38.1g}{254g/mol}$×$\frac{5}{3}$=0.25mol,故答案为:KIO3;0.25.
点评 本题考查混合物分离提纯及氧化还原反应,为高频考点,把握物质的性质、反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
7.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
(1)已知:KMnO4+H2C2O4+H2SO4→MnSO4+K2SO4+CO2↑+H20(未配平),向酸性KMnO4溶液中加入一定量的H2C2O4溶液,当溶液中的KMnO4耗尽后,紫色溶液将褪去.为确保能观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥2.5.
(2)为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案
表中x=2.0ml,理由是保证其它条件不变,只改变反应物H2C2O4浓度,从而达到对照实验的目的.
(1)已知:KMnO4+H2C2O4+H2SO4→MnSO4+K2SO4+CO2↑+H20(未配平),向酸性KMnO4溶液中加入一定量的H2C2O4溶液,当溶液中的KMnO4耗尽后,紫色溶液将褪去.为确保能观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥2.5.
(2)为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMnO4溶液 | H2O | ||
| V/mL | c(mol•L-1) | V/mL | c(mol•L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
11.有乙烯与乙炔的混合气体100mL,与280mL氧气充分反应,完全燃烧后生成二氧化碳的体积(以上气体体积均在相同状况下测定)
| A. | 小于200mL | B. | 200mL | C. | 大于200mL | D. | 无法确定 |
1.下列物质的熔、沸点高低顺序正确的是( )
| A. | F2>Cl2>Br2>I2 | B. | CF4>CCl4>CBr4>CI4 | ||
| C. | HF<HCl<HBr<HI | D. | CH4<SiH4<GeH4<SnH4 |
8.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4═3Br2+Na2SO4+3H2O,与上述反应在氧化还原反应原理上最相似的是( )
| A. | 3Cl2+6NaOH=2NaClO3+5NaCl+3H2O | |
| B. | CaH2+2H2O=Ca(OH)2+2H2↑ | |
| C. | AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl | |
| D. | 2CuO+Cu2S=4Cu+SO2↑ |
15.现有部分短周期元素的性质或原子结构如表且原子序数按XYTZ依次增大:
(1)四种元素原子半径由大到小的顺序是(写元素符号)S>Cl>C>N.
(2)元素Y与氢元素形成的一种离子YH4+,写出该微粒的电子式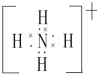 (用元素符号表示).
(用元素符号表示).
(3)T元素的简单阴离子的结构示意图是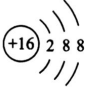 ,
,
(4)证明该粒子的还原性比Z-强的离子方程式是Cl2+S2-=S+2Cl-.
(5)元素Z的单质与氢氧化钠溶液反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
(6)将9g单质X在足量氧气中燃烧,所得气体通入1L 1mol•L-1NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为68.5g.
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 最外层电子数是电子层数的2倍 |
| Z | 元素最高正价是+7价 |
(2)元素Y与氢元素形成的一种离子YH4+,写出该微粒的电子式
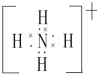 (用元素符号表示).
(用元素符号表示).(3)T元素的简单阴离子的结构示意图是
 ,
,(4)证明该粒子的还原性比Z-强的离子方程式是Cl2+S2-=S+2Cl-.
(5)元素Z的单质与氢氧化钠溶液反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
(6)将9g单质X在足量氧气中燃烧,所得气体通入1L 1mol•L-1NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为68.5g.
16.除去如表物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| B | 乙烷(乙烯) | 氢气 | 加热 |
| C | 溴(水) | 乙醇 | 蒸馏 |
| D | 乙醇(水) | 新制生石灰 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
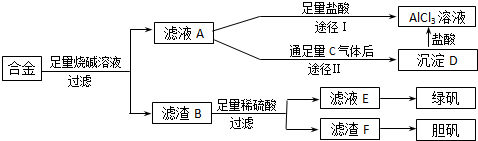
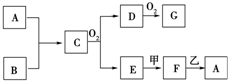 物质A~G均由短周期元素组成,A、B为非金属气体单质,B原子最外层电子数比次外层电子数的2倍还多1.甲、乙均为金属单质,且甲的原子半径在第三周期最大.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):
物质A~G均由短周期元素组成,A、B为非金属气体单质,B原子最外层电子数比次外层电子数的2倍还多1.甲、乙均为金属单质,且甲的原子半径在第三周期最大.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):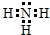 ;
;