题目内容
11.化学小组同学依据化学反应Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O制取22.4L(标准状况)SO2气体.取65.0g锌粒与98%的浓H2SO4(ρ=1.84g•cm-3)110mL充分反应,锌全部溶解.对于制得的气体,有同学认为可能混有氢气.为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究. (F中为无水硫酸铜)
请回答下列问题:
(1)装置A中添加液体的仪器名称为分液漏斗;98%的浓H2SO4(ρ=1.84g/cm3)的物质的量浓度是18.4 mol/L;
(2)请写出产生氢气的反应的离子方程式Zn+2H+═Zn2++H2↑;
(3)①装置B是为了吸收SO2,则不能选用下列试剂中的B(填序号);
A.NaOH溶液 B.浓H2SO4 C.KMnO4溶液
②可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有氢气的实验现象是装置E中黑色粉末变红色,F中无水硫酸铜变蓝色.
分析 根据题目给出的信息可知:随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2,因此化学小组所制得的气体中混有的主要杂质气体可能是氢气;A是制取气体的装置,B是吸收二氧化硫的装置,可以用氢氧化钠等碱液吸收;C是检验二氧化硫是否除尽的装置,D是浓硫酸,吸水干燥作用;E是用还原性气体还原氧化铜的装置,F中盛放的是无水硫酸铜,检验是否有水生成;G是防止空气中H2O进入干燥管而影响杂质气体的检验.
(1)该仪器名称是分液漏斗;C(H2SO4)=$\frac{1000ρw}{M}$;
(2)锌和稀硫酸反应生成硫酸锌和氢气;
(3)①二氧化硫属于酸性氧化物,能被碱液吸收;具有还原性,能被强氧化性溶液吸收;
②氢气具有还原性,能还原氧化铜,且生成水,水能使无水硫酸铜变蓝色.
解答 解:(1)该仪器名称是分液漏斗,C(H2SO4)=$\frac{1000ρw}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4 mol/L,
故答案为:分液漏斗;18.4 mol/L;
(2)锌和稀硫酸反应生成硫酸锌和氢气,离子方程式为Zn+2H+═Zn2++H2↑,故答案为:Zn+2H+═Zn2++H2↑;
(3)①二氧化硫属于酸性氧化物,能被碱液吸收;具有还原性,能被强氧化性溶液吸收,氢氧化钠溶液呈碱性,高锰酸钾溶液具有强氧化性,所以可以用氢氧化钠溶液和高锰酸钾溶液吸收二氧化硫,故选B,
故答案为:B;
②氢气具有还原性,能将黑色的CuO还原为红色的Cu,且生成水,水能使无水硫酸铜变蓝色,所以如果有氢气,看到的现象是:装置E中黑色粉末变红色,F中无水硫酸铜变蓝色,
故答案为:装置E中黑色粉末变红色,F中无水硫酸铜变蓝色.
点评 本题考查了探究实验,明确实验原理是解本题关键,根据物质的性质来分析解答,注意二氧化硫的漂白性,为常考查点.

| A. | 小于200mL | B. | 200mL | C. | 大于200mL | D. | 无法确定 |
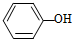
 、CH 3COOH、HCl的排列中,
、CH 3COOH、HCl的排列中, 应填入的物质是( )
应填入的物质是( )| A. | H2SO4 | B. | CH3CH2OH | C. | H2CO3 | D. | CH3COOCH3 |
| A. | 加入Cu(OH)2浊液之前,未用NaOH溶液中和硫酸 | |
| B. | 制Cu(OH)2时,硫酸铜溶液太稀,NaOH过量了 | |
| C. | 加热时间不充分,淀粉没有充分水解 | |
| D. | 所用淀粉浓度不够 |
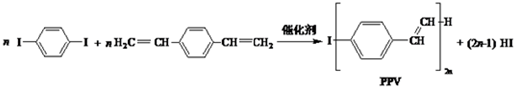
下列说法正确的是( )
| A. | 合成PPV的反应为缩聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. | 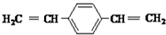 和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 通过红外光谱测定PPV的平均相对分子质量,可得其聚合度 |
| 混合物 | 试剂 | 分离方法 | |
| A | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| B | 乙烷(乙烯) | 氢气 | 加热 |
| C | 溴(水) | 乙醇 | 蒸馏 |
| D | 乙醇(水) | 新制生石灰 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 | |
| C. | 蒸馏操作时,温度计水银球的位置应在蒸馏烧瓶的支管口处 | |
| D. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |
| A. | K+、Na+、HSO3-、Cl- | B. | H+、Al3+、Fe3+、I- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | Na+、Ba2+、AlO2-、NO3- |