题目内容
7.NA表示阿伏加德罗常数的值,下列说法一定正确的是( )| A. | 标准状况下,2.24L氯气与足量的铁反应,转移电子数为0.2NA | |
| B. | 标准状况下,2.24L NO2所含电子总数为3.9 NA | |
| C. | 7.8gNa2S和Na2O2的混合物中含有的阴离子总数大于0.1 NA | |
| D. | 常温常压下,将0.1mol氯气通入水中发生化学反应,转移电子数为0.1 NA |
分析 A.2.24L氯气的物质的量是0.1mol,其与足量的铁反应,转移电子数为0.2NA;
B.NO2气体会有一部分发生反应转化为N2O4;
C.每个Na2S和Na2O2都含有1个阴离子;
D.反应是可逆反应.
解答 解:A.标准状况下,2.24L氯气的物质的量是0.1mol,其与足量的铁反应,转移电子数为0.2NA,故A正确;
B.NO2气体会有一部分发生反应转化为N2O4,所以标准状况下,2.24L NO2气体中所含电子总数为在2.3NA与4.6NA之间,不一定是3.9 NA,故B错误;
C.7.8gNa2S和Na2O2的物质的量是0.1mol,由于两种物质都是离子化合物,每个Na2S和Na2O2都含有1个阴离子,所以0.1mol Na2S和Na2O2的混合物中含有的阴离子总数等于0.1 NA,故C错误;
D.常温常压下,将0.1mol氯气通入水中发生化学反应,由于反应是可逆反应,所以转移电子数小于0.1 NA,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
18.某厂用Na 除掉苯中的水分.某次生产误将甲苯当做苯投进反应釜中,由于甲苯中含水量少,最后反应釜还残留大量的Na.下列处理方法更合理、更安全的是( )
| A. | 打开反应釜,将Na 暴露在空气中与氧气反应 | |
| B. | 向反应釜通入Cl2,Na 在Cl2中燃烧生成NaCl | |
| C. | 向反应釜加大量H2O,通过化学反应“除掉”金属钠 | |
| D. | 向反应釜滴加C2H5OH,并设置放气管,排出氢气和热量 |
15.工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
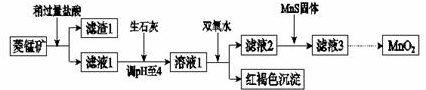
已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□4H2O=□Cl2↑+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试 纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度,有利于Mn2+放电(不利于Cl-放电).

已知:生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□4H2O=□Cl2↑+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试
 纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
纸置于阳极附近,若试纸变蓝则证明有Cl2生成.③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度,有利于Mn2+放电(不利于Cl-放电).
2.下列各选项有机物数目,与分子式为ClC4H7O2且能与碳酸氢钠反应生成气体的有机物数目相同的是(不含立体异构)( )
| A. | 分子式为C5H10的烯烃 | B. | 分子式为C4H8O2的酯 | ||
| C. | 甲苯(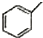 )的一氯代物 )的一氯代物 | D. | 立体烷( 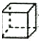 )的二氯代物 )的二氯代物 |
12.常温下,甲、乙、丙三位同学用实验确定某酸HA是弱电解质的方案分别是:
甲:用pH试纸测定0.1moI/L HA溶液的pH,即可证明HA是弱电解质;
乙:①分别取pH=l的HA溶液和稀盐酸各10.00mL,再加水稀释为100mL;
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质;
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表,分析表中数据可以说明HA是弱电解质;
(1)甲的方案中,说明HA是弱电解质的理由是测得溶液的pH>1(填“>”、“<”或“=”).甲进行实验时的具体操作方法是先把一小块pH试纸放在表面皿或玻璃片上,再用玻璃棒蘸驭溶液点在试纸的中部,待变色后,与标准比色卡对比确定溶液的pH.
(2)在乙的方案的第①步中,需要用到的定量仪器是酸式滴定管.pH均为1的HA溶液和稀盐酸中,水的电离程度的大小关系是c(填字母).
a.HA溶液中水的电离程度大 b.稀盐酸中水的电离程度大 c.两种溶液中水的电离程度相同
(3)乙的方案中,说明HA是弱电解质的主要现象是B(填字母).
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c>(填“>”、“<”或“=”)0.l,该混合液中的离子浓度:c(Na+)=(填“>”、“<”或“=”)c(A-).
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:强(填“强”、“弱”或“无法确定”).
甲:用pH试纸测定0.1moI/L HA溶液的pH,即可证明HA是弱电解质;
乙:①分别取pH=l的HA溶液和稀盐酸各10.00mL,再加水稀释为100mL;
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质;
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表,分析表中数据可以说明HA是弱电解质;
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
(2)在乙的方案的第①步中,需要用到的定量仪器是酸式滴定管.pH均为1的HA溶液和稀盐酸中,水的电离程度的大小关系是c(填字母).
a.HA溶液中水的电离程度大 b.稀盐酸中水的电离程度大 c.两种溶液中水的电离程度相同
(3)乙的方案中,说明HA是弱电解质的主要现象是B(填字母).
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c>(填“>”、“<”或“=”)0.l,该混合液中的离子浓度:c(Na+)=(填“>”、“<”或“=”)c(A-).
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:强(填“强”、“弱”或“无法确定”).
19.下列说法不正确的是( )
| A. | 氯气可用于自来水的消毒 | B. | 镁可用于制造信号弹和焰火 | ||
| C. | 氢氧化铁胶体能用于净水 | D. | 二氧化硫不可用于漂白纸浆 |
16.向amolNaOH的溶液中通入bmolCO2,下列说法不正确的是( )
| A. | 当a>2b时,发生的离子反应为:2OH-+CO2=CO32-+H2O | |
| B. | 当a<b时,发生的离子反应为:OH-+CO2=HCO3- | |
| C. | 当2a=3b时,发生的离子反应为:3OH-+2CO2=CO32-+HCO3-+H2O | |
| D. | 当0.5a<b<a时,溶液中HCO3-与CO32-的物质的量之比为(a-b):(2b-a) |
17.25℃时,用蒸馏水稀释1mol/L醋酸,下列各项始终保持增大趋势的是( )
| A. | $\frac{c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ | B. | $\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$ | ||
| C. | $\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$ | D. | c(H+)•c(CH3COO-) |