题目内容
16.向amolNaOH的溶液中通入bmolCO2,下列说法不正确的是( )| A. | 当a>2b时,发生的离子反应为:2OH-+CO2=CO32-+H2O | |
| B. | 当a<b时,发生的离子反应为:OH-+CO2=HCO3- | |
| C. | 当2a=3b时,发生的离子反应为:3OH-+2CO2=CO32-+HCO3-+H2O | |
| D. | 当0.5a<b<a时,溶液中HCO3-与CO32-的物质的量之比为(a-b):(2b-a) |
分析 二氧化碳和氢氧化钠的物质的量比大于等于1:1的时候,则为碳酸氢钠;如果二氧化碳和氢氧化钠的物质的量比小于等于1:2的时候,则为碳酸钠;介于1:1和1:2之间的时候则为碳酸钠和碳酸氢钠的混合物,依据方程式:2NaOH+CO2=Na2CO3+H2O,Na2CO3+CO2+H2O=2NaHCO3,计算解答.
解答 解:A.当a>2b时,氢氧化钠过量反应生成碳酸钠和水,离子方程式:2OH-+CO2=CO32-+H2O,故A正确;
B.当a<b时,二氧化碳过量反应生成碳酸氢钠,发生的离子反应为:OH-+CO2=HCO3-,故B正确;
C.当2a=3b时,二者反应生成等物质的量的碳酸钠和碳酸氢钠,发生的离子反应为3OH-+2CO2=CO32-+HCO3-+H2O,故C正确;
D.当0.5a<b<a时,依据方程式得:
2NaOH+CO2=Na2CO3+H2O
a 0.5a 0.5a
Na2CO3+CO2+H2O=2NaHCO3,
0.5a-( b-0.5a ) b-0.5a 2(b-0.5a)
溶液中HCO3-与CO32-的物质的量之比为2(b-0.5):[0.5-(b-0.5a)]=(2b-a):(a-b),故D错误;
故选:D.
点评 本题考查了离子方程式的书写,明确二氧化碳与氢氧化钠反应实质是解题关键,题目难度中等,注意反应物的物质的量对反应的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.NA表示阿伏加德罗常数的值,下列说法一定正确的是( )
| A. | 标准状况下,2.24L氯气与足量的铁反应,转移电子数为0.2NA | |
| B. | 标准状况下,2.24L NO2所含电子总数为3.9 NA | |
| C. | 7.8gNa2S和Na2O2的混合物中含有的阴离子总数大于0.1 NA | |
| D. | 常温常压下,将0.1mol氯气通入水中发生化学反应,转移电子数为0.1 NA |
4.下列说法正确的是( )
| A. | 煤是无机化合物,天然气和石油是有机化合物 | |
| B. | 利用化石燃料燃烧放出的热量使分解产生氢气,是氢能开发的研究方向 | |
| C. | 化学电源放电、植物光合作用都能发生化学变化,并伴随能量的转化 | |
| D. | 若化学过程中断开化学键放出的能量大于形成化学键所吸收的能量,则反应放热 |
11.X(g)+3Y(g)?2Z(g)△H=-a kJ•molˉ1,一定条件下,将1mol X和3mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol.下列说法正确的是( )
| A. | 10min内,Y的平均反应速率为0.03 mol•Lˉ1•sˉ1 | |
| B. | 第10min时,X的反应速率为0.01 mol•Lˉ1•minˉ1 | |
| C. | 10min内,消耗0.2 mol X,生成0.4 mol Z | |
| D. | 10min内,X和Y反应放出的热量为a kJ |
8.某矿石主要含CuO和Cu2(OH)2CO3,以及少量Fe2O3、FeO和SiO2.按如下流程可制得Cu3N和铁红.
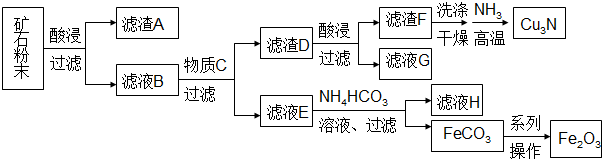
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 每生成1mol Cu3N,转移的电子为6mol | |
| B. | 滤液G可以并入滤液E加以利用 | |
| C. | 加入NH4HCO3溶液需控制温度以抑制Fe2+水解和NH4HCO3分解 | |
| D. | 由FeCO3转化为Fe2O3的操作包括洗涤、干燥、空气中煅烧 |
5.如表实验操作正确且能达到预期目的是( )
| 实验目的 | 操作 | |
| A | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液 |
| B | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| C | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| D | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
| A. | A | B. | B | C. | C | D. | D |
6.X、Y、Z、W属于短周期主族元素.X元素的原子半径最大,Y元素的最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子核外电子数之比为2:1,下列说法中错误的是( )
| A. | X与Y形成的两种化合物中阴阳离子个数比为1:2 | |
| B. | Y分别与Z、W、R以两种元素组成的常见化合物有5种 | |
| C. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物熔沸点低 | |
| D. | Z、W、R的最高价氧化物对应水化物的酸性强弱顺序是R>W>Z |