题目内容
2.从海水中提取溴的过程可采用如图表示: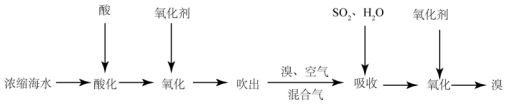
(1)氧化海水中的Br所用的氧化剂一般为Cl2;
(2)在酸性条件下,而不能在碱性..条件下氧化Br的原因是(用化学方程式表示)3Br2+6OH-=5Br-+BrO3-+3H2O;
(3)氧化后生成的单质溴为什么可用热空气吹出?原因是溴单质易挥发;
(4)用热空气吹出的Br2用SO2和水吸收,写出这一反应的化学方程式Br2+SO2+2H2O=2HBr+H2SO4,该反应中SO2体现还原性(选填氧化性、还原性、漂白性或酸性).
分析 浓缩的海水中加入酸酸化后通入氧化剂氯气,氧化溴离子生成单质溴,利用溴单质易挥发用热空气吹出,用二氧化硫水溶液吸收溴单质,再通入氯气氧化HBr生成溴单质,得到高浓度的溴单质,
(1)氧化溴离子的氧化剂为氯气;
(2)碱性条件下溴单质会发生氧化还原反应;
(3)溴单质易挥发;
(4)溴单质和二氧化硫再水溶液中发生氧化还原反应生成硫酸和溴化氢,反应中二氧化硫表现还原性.
解答 解:浓缩的海水中加入酸酸化后通入氧化剂氯气,氧化溴离子生成单质溴,利用溴单质易挥发用热空气吹出,用二氧化硫水溶液吸收溴单质,再通入氯气氧化HBr生成溴单质,得到高浓度的溴单质,
(1)氧化溴离子需要氧化剂,氧化海水中的Br-所用的氧化剂一般为氯气,故答案为:Cl2;
(2)碱性条件下溴单质会发生氧化还原反应,3Br2+6OH-=5Br-+BrO3-+3H2O,
故答案为:3Br2+6OH-=5Br-+BrO3-+3H2O;
(3)溴单质易挥发,氧化后生成的单质溴可用热空气吹出,故答案为:溴单质易挥发;
(4)溴单质和二氧化硫再水溶液中发生氧化还原反应生成硫酸和溴化氢,Br2+SO2+2H2O=2HBr+H2SO4.反应中二氧化硫化合价+4价变化为+6价表现还原性,
故答案为:Br2+SO2+2H2O=2HBr+H2SO4;还原.
点评 本题考查了溴的提纯、富集等流程分析判断,主要是溴单质性质、溴离子和溴酸根离子在酸性溶液中发生的氧化还原反应,掌握基础是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.根据下列反应所画图象正确的是( )
| A | B | C | D |
| 将二氧化硫通入到一定量氯水中 | 将氯化铝溶液滴入到一定量NaOH溶液中 | NaOH溶液加入AlCl3、Mg(NO3)2、HNO3溶液 | 将铁粉加入到一 定量氯化铁溶液中 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
17.分子式为C6H10O4,且能与NaHCO3反应的只含一种官能团的有机物共有(不含立体异构)( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
7.下列图示与对应的叙述相符的是( )
| A. | 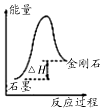 如图所示,从能量角度考虑,石墨比金刚石稳定 | |
| B. | 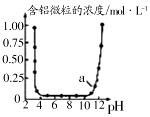 图表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+ | |
| C. | 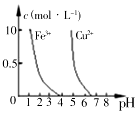 如图所示,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 | |
| D. | 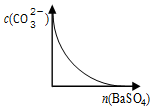 如图所示,在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的变化 |
14.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将氨水滴加到饱和的FeCl3溶液中并加热 |
| B | 由AlCl3溶液制备无水AlCl3 | 将AlCl3溶液加热蒸干 |
| C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D | 除去HBr中混有的Br2蒸汽 | 将混合气体通入盛有CCl4的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
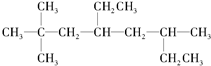 烃A的一氯代物具有不同沸点的产物有10种.
烃A的一氯代物具有不同沸点的产物有10种.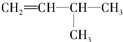 的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.
的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.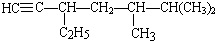 的系统名称是5,6-二甲基-3-乙基-1-庚烯,将其在催化剂存在条件下完全氢化,所得烷烃的系统名称为2,3-二甲基-5-乙基-庚烷.
的系统名称是5,6-二甲基-3-乙基-1-庚烯,将其在催化剂存在条件下完全氢化,所得烷烃的系统名称为2,3-二甲基-5-乙基-庚烷.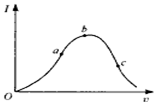 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答: .
.