题目内容
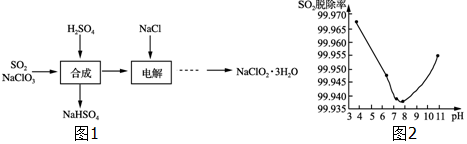
12.根据下列反应所画图象正确的是( )| A | B | C | D |
| 将二氧化硫通入到一定量氯水中 | 将氯化铝溶液滴入到一定量NaOH溶液中 | NaOH溶液加入AlCl3、Mg(NO3)2、HNO3溶液 | 将铁粉加入到一 定量氯化铁溶液中 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A、二氧化硫与氯气反应生成硫酸和盐酸,酸性增强,pH减小;
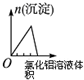
B、将氯化铝溶液滴入到一定量NaOH溶液中开始无沉淀,将氢氧根转化为偏铝根离子,然后滴入氯化铝产生沉淀;
C、NaOH溶液加入AlCl3、Mg(NO3)2、HNO3溶液,氢氧化钠首先与硝酸反应,然后与镁离子和铝离子反应生成氢氧化铝和氢氧化镁沉淀,随后氢氧化铝溶解,最后只有氢氧化镁沉淀;
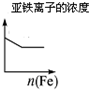
D、铁与铁离子发生氧化还原反应生成亚铁离子.
解答 解:A、SO2+Cl2+2H2O=2HCl+H2SO4,生成物酸性增强,pH减小,故A正确;
B、将氯化铝溶液滴入到一定量NaOH溶液中开始无沉淀,将氢氧根转化为偏铝根离子,然后滴入氯化铝产生沉淀,后然后沉淀逐渐增加,直到偏铝酸根离子完全沉淀,沉淀量达到最大值,最后不变,图象不符合,故B错误;
C、NaOH溶液加入AlCl3、Mg(NO3)2、HNO3溶液,氢氧化钠首先与硝酸反应,然后与镁离子和铝离子反应生成氢氧化铝和氢氧化镁沉淀,随后氢氧化铝溶解,最后只有氢氧化镁沉淀,所以无中间平衡于横坐标的一条线段,故C错误;
D、铁与铁离子发生氧化还原反应生成亚铁离子,所以亚铁离子的浓度增大,而不是减小,故D错误;
故选A.
点评 本题考查了元素化合物的性质,题目难度不大,题目涉及铝的化合物、氯水、二氧化硫、铁离子等物质,侧重于基础知识的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,每生成2.24L O2,转移的电子数一定为0.4NA | |
| B. | 常温下,7.8g苯中所含C-H数位0.6NA | |
| C. | 常温常压下,1.8g甲基(-CD3)中含有的中子数为NA | |
| D. | 25℃时,1.0L PH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
7.已知25℃、101kpa时,一些物质的燃烧热为:
请回答下列问题.
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.5KJ•mol-1.
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)?CH3OH(l);△H=-128.1KJ•mol-1.
(3)工业上利用水煤气合成甲醇的主要反应可表示为0.5CO(g)+H2(g)?0.5CH3OH(g)△H=-45.4kJ•mol-1.向容积为1L的密闭容器中加入0.10mol H2和0.05mol CO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ.
①相同温度条件下,上述反应的化学平衡常数K=100.
②若容器容积不变,下列措施可增加CH3OH产率的是BD(填写序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入0.10mol H2和0.05molCO
E.加入催化剂
③反应达到平衡后,保持其他条件不变,若只把容器的体积缩小一半,平衡将正向(选填“逆向”“正向”或“不”)移动,化学平衡常数K不变(选填“增大”“减小”或“不变”).
④温度、容积相同的甲、乙两个密闭容器,若甲中加入1molCO和2mol H2,乙中加入1mol CH3OH(g),反应达到平衡时甲放出的热量为Q1kJ,乙吸收的热量为Q2 kJ,反应物的转化率分别为a1、a2.则Q1+Q2=90.8;a1+a2=1.
| 化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| △H/(kJ/mol) | -283.0 | -285.8 | -726.5 | -890.3 |
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.5KJ•mol-1.
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)?CH3OH(l);△H=-128.1KJ•mol-1.
(3)工业上利用水煤气合成甲醇的主要反应可表示为0.5CO(g)+H2(g)?0.5CH3OH(g)△H=-45.4kJ•mol-1.向容积为1L的密闭容器中加入0.10mol H2和0.05mol CO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ.
①相同温度条件下,上述反应的化学平衡常数K=100.
②若容器容积不变,下列措施可增加CH3OH产率的是BD(填写序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入0.10mol H2和0.05molCO
E.加入催化剂
③反应达到平衡后,保持其他条件不变,若只把容器的体积缩小一半,平衡将正向(选填“逆向”“正向”或“不”)移动,化学平衡常数K不变(选填“增大”“减小”或“不变”).
④温度、容积相同的甲、乙两个密闭容器,若甲中加入1molCO和2mol H2,乙中加入1mol CH3OH(g),反应达到平衡时甲放出的热量为Q1kJ,乙吸收的热量为Q2 kJ,反应物的转化率分别为a1、a2.则Q1+Q2=90.8;a1+a2=1.
4.下列各图是中学化学常见的几个实验操作,其中错误的是( )
| A. |  | B. |  | C. |  | D. |  |