题目内容
实验室用NaOH固体配制0.1mol/L的NaOH溶液490mL.
(1)实验步骤:用托盘天平上称取 gNaOH,放在烧杯里用适量的蒸馏水使之完全溶解 .然后,把所得的溶液通过玻璃棒引流小心地注入 mL容量瓶中,然后用蒸馏水洗涤烧杯和容量瓶,把每次洗下来的水都注入容量瓶中.缓缓地把蒸馏水注入容量瓶直到离刻度线处 ,然后改用 滴加蒸馏水,使 与刻度线相切,最后把容量瓶塞塞好,摇匀,即配制成0.1mol/L的NaOH溶液.在使用容量瓶前,用蒸馏水洗净后, (填“需要”或“不需要”)将容量瓶进行干燥.
(2)下列操作对NaOH的物质的量浓度有什么影响(偏高、偏低或无影响)
①称量时,将药品放在右盘,砝码放在左盘: .
②容量瓶用水洗净后还残留少量蒸馏水: .
③定容时俯视容量瓶的刻度线: .
(1)实验步骤:用托盘天平上称取
(2)下列操作对NaOH的物质的量浓度有什么影响(偏高、偏低或无影响)
①称量时,将药品放在右盘,砝码放在左盘:
②容量瓶用水洗净后还残留少量蒸馏水:
③定容时俯视容量瓶的刻度线:
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)根据n=cV和m=nM来计算;据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析;容量瓶使用时不需要进行干燥;
(2)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
(2)根据c=
| n |
| V |
解答:
解:(1)容量瓶的规格没有490mL,只能用500mL,根据n=cV可知需要的NaOH的物质的量n=0.5L×0.1mol/L=0.05mol,质量m=nM=0.05mol×40g/mol=2.0g;
操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却至室温转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液凹液面与刻度线相切,最后把容量瓶塞塞好,摇匀;容量瓶使用时不需要进行干燥;
故答案为:2.0;冷却至室温;500;1-2cm;胶头滴管;溶液凹液面;不需要;
(2)①称量时,将药品放在右盘,砝码放在左盘,溶质的质量不变,仍然为2.0g,浓度不变,故答案为:无影响;
②若容量瓶用水洗净后还残留少量蒸馏水,溶液的体积不变,对溶液浓度无影响,故答案为:无影响;
③定容时俯视容量瓶的刻度线,溶液的体积偏小,浓度偏高,故答案为:偏高.
操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却至室温转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液凹液面与刻度线相切,最后把容量瓶塞塞好,摇匀;容量瓶使用时不需要进行干燥;
故答案为:2.0;冷却至室温;500;1-2cm;胶头滴管;溶液凹液面;不需要;
(2)①称量时,将药品放在右盘,砝码放在左盘,溶质的质量不变,仍然为2.0g,浓度不变,故答案为:无影响;
②若容量瓶用水洗净后还残留少量蒸馏水,溶液的体积不变,对溶液浓度无影响,故答案为:无影响;
③定容时俯视容量瓶的刻度线,溶液的体积偏小,浓度偏高,故答案为:偏高.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
 一定温度下,某容积恒定的密闭容器中发生如下可逆反应:
一定温度下,某容积恒定的密闭容器中发生如下可逆反应:CO(g)+H2(g)?C(s)+H2O(g);△H<0以l mol CO和2mol H2为起始反应物,tl时达到平衡,生成0.6mol H2O(g).t2时改变反应条件,化学反应速率(v)与时间(t)的关系如图所示.下列叙述正确的是( )
| A、起始时刻和t1达到平衡后气体的物质的量之比为5:4 |
| B、平衡后若加入少量碳,平衡向逆反应方向移动 |
| C、平衡后若加入氢气,上述反应的△H会增大 |
| D、t2时改变的条件可能是升高温度 |
不用任何试剂,只利用滴加顺序就能区分下列溶液的是( )
| A、硫酸和氢氧化钡 |
| B、碳酸钠和盐酸 |
| C、碳酸氢钠和盐酸 |
| D、氢氧化钠和盐酸 |
某气体由氢气、一氧化碳、甲烷中的一种或几种组成.点燃该气体后,在火焰上方罩一冷而干燥的烧杯,烧杯内壁出现水雾;把烧杯迅速倒转过来,注入少量澄清石灰水,振荡,石灰水变混浊.下列对气体组成的推断不正确的是( )
| A、可能三种气体都存在 |
| B、可能只有氢气 |
| C、可能是甲烷和一氧化碳的混合气体 |
| D、可能只有甲烷 |
化学与生活、社会密切相关.下列说法正确的是( )
| A、硫在过量的氧气中燃烧生成三氧化硫 |
| B、氢氧燃料电池、铅蓄电池、硅太阳能电池中都利用了原电池原理 |
| C、氨气溶于水显碱性,可以用湿润的红色石蕊试纸检验氨气的生成 |
| D、Mg可由电解熔融的MgCl2制取,Al也可由电解熔融AlCl3制取 |
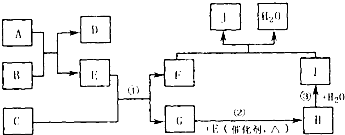
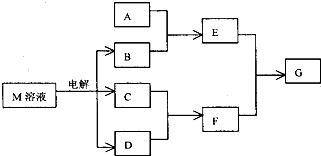 已知M是由X、Y两种位于同周期的元素组成的离子化合物,且X+与氖原子具有相同的电子层结构,Y元素的最高正价与它的负价代数和为6.M与相关物质的转化关系如图(部分产物已略去):
已知M是由X、Y两种位于同周期的元素组成的离子化合物,且X+与氖原子具有相同的电子层结构,Y元素的最高正价与它的负价代数和为6.M与相关物质的转化关系如图(部分产物已略去):