题目内容
如图所示是短周期内八种元素单质的沸点与原子序数的关系图,下列说法正确的是( )

| A、上述元素中,A的最高价氧化物对应的水化物酸性最强 |
| B、简单离子的半径依A、B、C、D的顺序依次减小 |
| C、工业上可通过电解H的熔融氯化物的方法制备H的单质 |
| D、F的简单离子与C、D的简单离子构成的化合物都是盐 |
考点:原子结构与元素的性质
专题:元素周期律与元素周期表专题
分析:由图可知A的沸点很高,则A为C,B、C、D、E单质的沸点小于零,则分别为N元素、O元素、F元素、Ne元素,F、G、H的单质的沸点大于零,则分别为Na元素、Mg元素、Al元素,结合元素的性质分析.
解答:
解:由图可知A的沸点很高,则A为C,B、C、D、E单质的沸点小于零,则分别为N元素、O元素、F元素、Ne元素,F、G、H的单质的沸点大于零,则分别为Na元素、Mg元素、Al元素,
A、由以上推断可知A为C元素,其最高价氧化物对应的水化物为碳酸,属于弱酸,B为N元素其最高价氧化物对应的水化物为强酸,故A错误;
B、同周期从左到右阴离子的半径依次减小,故B正确;
C、由以上推断可知H为Al元素,工业上可通过电解熔融氧化铝的方法制备Al的单质,氯化铝熔融时不导电,不能电解,故C错误;
D、由以上推断可知F为Na元素,C为O元素,Na与O形成的是氧化物,不是盐,故D错误;
故选B.
A、由以上推断可知A为C元素,其最高价氧化物对应的水化物为碳酸,属于弱酸,B为N元素其最高价氧化物对应的水化物为强酸,故A错误;
B、同周期从左到右阴离子的半径依次减小,故B正确;
C、由以上推断可知H为Al元素,工业上可通过电解熔融氧化铝的方法制备Al的单质,氯化铝熔融时不导电,不能电解,故C错误;
D、由以上推断可知F为Na元素,C为O元素,Na与O形成的是氧化物,不是盐,故D错误;
故选B.
点评:本题考查了元素周期律与元素周期表,侧重于考查学生分析图象和从图象中提取信息及利用信息解决问题的能力,题目难度中等.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
下列离子方程式正确的是( )
| A、过氧化钠与水反应:2O22-+2H2O═O2↑+4OH- |
| B、次氯酸钠与Fe(OH)3在碱性溶液中反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
| C、向明矾[KAl(SO4)2?12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| D、向碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-═Mg(OH)2↓+2CaCO3↓+2H2O |
能正确表示下列反应的离子方程式是( )
| A、Na2O2与H2O反应:Na2O2+H2O=2Na++2OH-+O2↑ |
| B、硫酸铝与过量氨水反应:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| C、用FeCl3溶液腐蚀铜线路板:Cu+Fe3+=Cu2++Fe2+ |
| D、NO2溶于水:3NO2+H2O=2H++2NO3-+NO |
室温下将等物质的量的CH3COONa和CH3COOH溶于一定量水中,再加入适量稀氢氧化钠,调整溶液pH=7.下列说法正确的是( )
| A、未加入稀氢氧化钠之前c(CH3COO-)<c(CH3COOH) |
| B、加稀氢氧化钠后溶液中[c(CH3COO-)?c(H+)]/c(CH3COOH)变大 |
| C、加稀氢氧化钠后CH3COOH的电离程度减小,但c( OH-)增大 |
| D、pH=7时,溶液中c( Na+)=c(CH3COO-) |
NA表示阿伏加德罗常数,下列说法中不正确的是( )
| A、KIO3+6HI=KI+3H2O+3I2,生成3mol I2转移电子的总数为5NA |
| B、标准状况下,5.6L氧气中含有O的总数为0.5NA |
| C、25℃时,pH=13的Ba(OH)2溶液1.0L中含有OH-总数为0.1NA |
| D、20g重水(D2O)中所含电子总数为8NA |
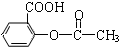 ).为测定某解热镇痛药阿斯
).为测定某解热镇痛药阿斯 冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.
冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.