题目内容
解热镇痛阿斯匹林的有效成分是乙酰水杨酸(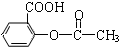 ).为测定某解热镇痛药阿斯
).为测定某解热镇痛药阿斯
匹林产品的纯度,称取样品0.25g,准确加入0.10mol/L NaOH溶液50mL,煮沸60min,发生如下反应:
 冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.
冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.
(1)计算0.25g阿斯匹林样品反应消耗的NaOH的物质的量(除乙酰水杨酸外,其他物质不与NaOH反应).
(2)计算该产品中乙酰水杨酸的含量(乙酰水杨酸的摩尔质量是180g/mol). .
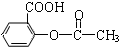 ).为测定某解热镇痛药阿斯
).为测定某解热镇痛药阿斯匹林产品的纯度,称取样品0.25g,准确加入0.10mol/L NaOH溶液50mL,煮沸60min,发生如下反应:
 冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.
冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.(1)计算0.25g阿斯匹林样品反应消耗的NaOH的物质的量(除乙酰水杨酸外,其他物质不与NaOH反应).
(2)计算该产品中乙酰水杨酸的含量(乙酰水杨酸的摩尔质量是180g/mol).
考点:化学方程式的有关计算
专题:计算题
分析:n(HCl)=0.025L×0.1mol/L=0.0025mol,根据n(NaOH)=n(HCl)+3n(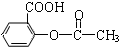 )计算0.25g阿斯匹林样品反应消耗的NaOH的物质的量,并以此计算产品中乙酰水杨酸的含量.
)计算0.25g阿斯匹林样品反应消耗的NaOH的物质的量,并以此计算产品中乙酰水杨酸的含量.
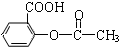 )计算0.25g阿斯匹林样品反应消耗的NaOH的物质的量,并以此计算产品中乙酰水杨酸的含量.
)计算0.25g阿斯匹林样品反应消耗的NaOH的物质的量,并以此计算产品中乙酰水杨酸的含量.解答:
解:n(HCl)=0.025L×0.1mol/L=0.0025mol,n(NaOH)=0.05L×0.1mol/L=0.005mol,
(1)与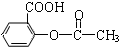 反应的氢氧化钠的物质的量为0.005mol-0.0025mol=0.0025mol,
反应的氢氧化钠的物质的量为0.005mol-0.0025mol=0.0025mol,
故答案为:0.0025mol;
(2)n(NaOH)=n(HCl)+3n(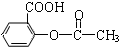 ),则m(
),则m(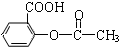 )=0.0025mol×
)=0.0025mol×
×180g/mol=0.15g,
该产品中乙酰水杨酸的含量为
×100%=60%,
故答案为:60%.
(1)与
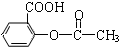 反应的氢氧化钠的物质的量为0.005mol-0.0025mol=0.0025mol,
反应的氢氧化钠的物质的量为0.005mol-0.0025mol=0.0025mol,故答案为:0.0025mol;
(2)n(NaOH)=n(HCl)+3n(
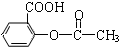 ),则m(
),则m(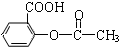 )=0.0025mol×
)=0.0025mol×| 1 |
| 3 |
该产品中乙酰水杨酸的含量为
| 0.15g |
| 0.25g |
故答案为:60%.
点评:本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意根据反应的方程式结合质量守恒解答该题,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、某盐的水溶液呈酸性,该盐一定是强酸弱碱盐 |
| B、盐类水解的过程破坏了水的电离平衡 |
| C、室温时向AgCl饱和溶液中加入AgNO3固体,c(Cl-)不变 |
| D、室温时pH=3的溶液与pH=11的溶液等体积混合所得溶液一定呈中性 |
如图所示是短周期内八种元素单质的沸点与原子序数的关系图,下列说法正确的是( )

| A、上述元素中,A的最高价氧化物对应的水化物酸性最强 |
| B、简单离子的半径依A、B、C、D的顺序依次减小 |
| C、工业上可通过电解H的熔融氯化物的方法制备H的单质 |
| D、F的简单离子与C、D的简单离子构成的化合物都是盐 |
原子结构决定元素的性质,下列说法中,正确的是( )
| A、Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小 |
| B、在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的其沸点也一定最高 |
| C、第2周期元素的最高正化合价都等于其原子的最外层电子数 |
| D、非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 |
 在如图所示的物质转化关系中A是一种活泼的金属,B是无色液态化合物,其分子含10个电子,在常温下F、H都是无色气体.(生成的水没有列出)
在如图所示的物质转化关系中A是一种活泼的金属,B是无色液态化合物,其分子含10个电子,在常温下F、H都是无色气体.(生成的水没有列出) 二氧化碳、碳酸钠和碳酸氢钠都是碳的重要化合物,它们在生活生产中都有着广泛的应用.甲、乙、丙三组同学分别对二氧化碳、碳酸钠、碳酸氢钠的相关问题进行了以下探究,请你参与并完成对有关问题的解答.
二氧化碳、碳酸钠和碳酸氢钠都是碳的重要化合物,它们在生活生产中都有着广泛的应用.甲、乙、丙三组同学分别对二氧化碳、碳酸钠、碳酸氢钠的相关问题进行了以下探究,请你参与并完成对有关问题的解答. (I)CH3+、CH3-、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
(I)CH3+、CH3-、CH3-都是重要的有机反应中间体,有关它们的说法正确的是 化合物A的分子式为C3H6O2转化关系如图:
化合物A的分子式为C3H6O2转化关系如图: