题目内容
4.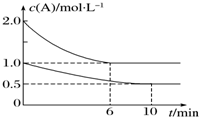 在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )
在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )| A. | 甲和乙中A的平衡转化率相等 | |
| B. | 给甲容器加压可缩短反应达到平衡的时间 | |
| C. | 给乙容器升温可缩短反应达到平衡的时间 | |
| D. | 甲容器中A的反应速率为0.1 mol•L-1•min-1 |
分析 向甲容器中再充入2molA、2molB,可以等效为原平衡状态下压强增大一倍,平衡向正反应方向移动,A转化率增大,平衡移动目的是降低浓度增大趋势,但不能消除浓度增大,达新平衡时浓度比原平衡大,由此分析解答.
解答 解:A、再充入2molA、2molB,可以等效为原平衡状态下压强增大一倍,平衡向正反应方向移动,A转化率增大,所以甲和乙中A的平衡转化率不相等,故A错误;
B、给甲容器加压,反应速率加快,可缩短反应达到平衡的时间,故B正确;
C、温度越高反应速率越快,缩短反应达到平衡的时间,故C正确;
D、时间段不清楚,无法求速率,故D错误;
故选D.
点评 考查平衡图象、等效平衡、外界条件对平衡影响、平衡计算等,难度中等,根据图象计算平衡时转化率,确定x值是解题的关键,注意B选项中压强影响平衡移动的本质是改变体积进而影响反应混合物各组分的浓度,若反应混合物难度不发生变化,平衡不移动.是易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.在同体积同浓度的H2SO4、HCl、HNO3、CH3COOH溶液中,分别加入足量的Zn,下列说法中正确的是( )
| A. | 硫酸中放出氢气量最多 | B. | 醋酸中放出氢气量最多 | ||
| C. | 盐酸中放出的氢气量最多 | D. | 盐酸和硝酸中放出的氢气相等 |
12.某溶液中有100mL2mol•L-1 XO4-阴离子,加入300mL1mol•L-1 Na2SO3恰好完全反应,已知Na2SO3被氧化成Na2SO4,则还原产物中X元素的化合价为( )
| A. | 0 | B. | +1 | C. | +3 | D. | +4 |
19.把0.8mol CO2通入含1mol NaOH的溶液中完全反应,其反应产物为( )
| A. | 0.5mol Na2CO3 | B. | 0.2mol Na2CO3、0.6mol NaHCO3 | ||
| C. | 1mol NaHCO3 | D. | 0.6mol Na2CO3、0.2mol NaHCO3 |
9.相同温度下,相同物质的量浓度的下列溶液:
①CH3COONa、②NH4Cl、③Na2SO4、④NaHSO4、⑤NH3•H2O,
按pH由大到小顺序排列正确的是( )
①CH3COONa、②NH4Cl、③Na2SO4、④NaHSO4、⑤NH3•H2O,
按pH由大到小顺序排列正确的是( )
| A. | ⑤①③②④ | B. | ④②③①⑤ | C. | ①⑤③②④ | D. | ①⑤③④② |
14.溶液的PH与所加水的质量关系图符合的是( )
| A. | 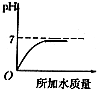 | B. | 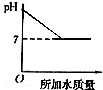 | C. | 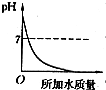 | D. |  |