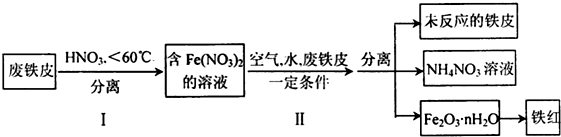
题目内容
15.用双线桥法表示下述氧化还原反应的电子转移,化合价变化,所发生的反应.2FeCl3+Fe═3FeCl2
C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
分析 2FeCl3+Fe═3FeCl2反应中Fe元素化合价由0价变为+2价、另一部分Fe元素化合价由+3价变为+2价,转移电子总数为2;
C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O反应中C元素化合价由0价变为+4价、N元素化合价由+5价变为+4价,所以碳作还原剂、硝酸作氧化剂,转移电子数是4,据此分析解答.
解答 解:2FeCl3+Fe═3FeCl2反应中Fe元素化合价由0价变为+2价、另一部分Fe元素化合价由+3价变为+2价,转移电子总数为2,其转移电子方向和数目为 ;
;
C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O反应中C元素化合价由0价变为+4价、N元素化合价由+5价变为+4价,得失电子最小公倍数是4,则转移电子数为4,所以电子转移的方向和数目为 ;
;
故答案为: ;
; .
.
点评 本题考查氧化还原反应,侧重于基本概念、电子转移表示方法的考查,明确常见元素的化合价及反应中元素的化合价变化是解答本题的关键,难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案
相关题目
5.今有甲、乙、丙、丁、戊5种物质,在一定条件下,它们能按如图方式进行转化:
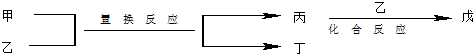
其推断正确的是( )

其推断正确的是( )
| 选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
| NH3 | O2 | NO | H2O | NO2 | |
| Mg | CO2 | C | MgO | CO | |
| C | H2O | CO | H2 | CO2 | |
| FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
6.以下实验操作简便、科学且成功的是( )
| A. | 将乙酸和乙醇的混合物注入浓硫酸中制备乙酸乙酯 | |
| B. | 将铜丝在酒精灯的外焰上加热变黑后,插入乙醇溶液中铜丝又恢复到原来的红色 | |
| C. | 往试管中注入2mLCuSO4溶液,再滴几滴NaOH溶液后,加入乙醛溶液即有红色沉淀产生 | |
| D. | 向淀粉溶液中加入稀硫酸加热,一段时间后,再加入银氨溶液检验是否水解 |
3.现有三种常见治疗胃酸过多症状的药物,它们的抑酸效果大小的顺序是 ( )
| 序号 | 名 称 | 抑酸成分 | 主要成分含量/片 |
| ① | INDICALM | CaCO3 | 250mg |
| ② | Stamachease | Al(OH)3 | 250mg |
| ③ | Fash digestion | MgO | 250mg |
| A. | ①=②=③ | B. | ①>②>③ | C. | ③>②>① | D. | ②>③>① |
20.下列反应一定属于吸热反应的是( )
| A. | 酸碱中和反应 | B. | 氯酸钾分解为氧气和氯化钾的反应 | ||
| C. | 物质燃烧反应 | D. | 实验室制H2的反应 |
7.下列说法中正确的是( )
| A. | 用明矾对自来水进行杀菌消毒 | |
| B. | 钠长期放置在空气中,最终将变成碳酸氢钠 | |
| C. | CCl4、Cl2及HF中的原子都满足最外层8电子稳定结构 | |
| D. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I |
4.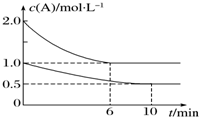 在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )
在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )
 在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )
在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )| A. | 甲和乙中A的平衡转化率相等 | |
| B. | 给甲容器加压可缩短反应达到平衡的时间 | |
| C. | 给乙容器升温可缩短反应达到平衡的时间 | |
| D. | 甲容器中A的反应速率为0.1 mol•L-1•min-1 |