题目内容
12.某溶液中有100mL2mol•L-1 XO4-阴离子,加入300mL1mol•L-1 Na2SO3恰好完全反应,已知Na2SO3被氧化成Na2SO4,则还原产物中X元素的化合价为( )| A. | 0 | B. | +1 | C. | +3 | D. | +4 |
分析 n(Na2SO3)=0.300L×1mol•L-1=0.3mol,n(XO4-)=0.100L×2mol•L-1=0.2mol,XO4-和Na2SO3发生氧化还原反应生成Na2SO4,根据原子守恒计算RX素在还原产物中的化合价,据此分析解答.
解答 解:n(Na2SO3)=0.300L×1mol•L-1=0.3mol,n(XO4-)=0.100L×2mol•L-1=0.2mol,XO4-和Na2SO3发生氧化还原反应生成Na2SO4,设X元素在还原产物中的化合价为x,根据转移电子守恒得0.3mol×(6-4)=0.2×(7-x),x=+4.
故选D.
点评 本题考查氧化还原反应的计算,侧重考查学生分析能力、计算能力,明确转移电子守恒是解本题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)?2Z(g)△H<0.当改变某个条件并达到新平衡后,下列叙述正确的( )
| A. | 升高温度,X的体积分数减小 | |
| B. | 增大压强(缩小容器容积),Z的浓度不变 | |
| C. | 保持容器容积不变,充入一定量的惰性气体,Y的浓度不变 | |
| D. | 保持容器容积不变,充入一定量的Z,X的体积分数增大 |
3.现有三种常见治疗胃酸过多症状的药物,它们的抑酸效果大小的顺序是 ( )
| 序号 | 名 称 | 抑酸成分 | 主要成分含量/片 |
| ① | INDICALM | CaCO3 | 250mg |
| ② | Stamachease | Al(OH)3 | 250mg |
| ③ | Fash digestion | MgO | 250mg |
| A. | ①=②=③ | B. | ①>②>③ | C. | ③>②>① | D. | ②>③>① |
20.下列反应一定属于吸热反应的是( )
| A. | 酸碱中和反应 | B. | 氯酸钾分解为氧气和氯化钾的反应 | ||
| C. | 物质燃烧反应 | D. | 实验室制H2的反应 |
7.下列说法中正确的是( )
| A. | 用明矾对自来水进行杀菌消毒 | |
| B. | 钠长期放置在空气中,最终将变成碳酸氢钠 | |
| C. | CCl4、Cl2及HF中的原子都满足最外层8电子稳定结构 | |
| D. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I |
17.下列对有机物结构或性质的描述,错误的是( )
| A. | 苯分子中的6个碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间的独特的键 | |
| B. | 将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| D. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
4.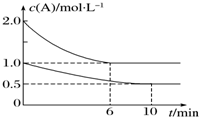 在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )
在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )
 在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )
在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )| A. | 甲和乙中A的平衡转化率相等 | |
| B. | 给甲容器加压可缩短反应达到平衡的时间 | |
| C. | 给乙容器升温可缩短反应达到平衡的时间 | |
| D. | 甲容器中A的反应速率为0.1 mol•L-1•min-1 |
1.将下列各组物质按酸、碱、盐分类顺序排列,其中正确的是( )
| A. | 盐酸、苛性钠、偏铝酸钠 | B. | 硅酸、乙醇、小苏打 | ||
| C. | 硫酸、纯碱、硅酸钠 | D. | 碳酸、烧碱、一水合氨 |
2.若NA表示阿伏加德罗常数的值,在4(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$N2+6NH3+3SO2+SO3+7H2O的反应中,当有NA个电子发生转移时,以下说法错误的是( )
| A. | 有$\frac{1}{2}$NA个硫原子被还原 | B. | 有$\frac{1}{3}$NA个氮原子被氧化 | ||
| C. | 有$\frac{3}{4}$NA个二氧化硫分子生成 | D. | 有$\frac{2}{3}$NA个硫酸铵分解 |