题目内容
9.相同温度下,相同物质的量浓度的下列溶液:①CH3COONa、②NH4Cl、③Na2SO4、④NaHSO4、⑤NH3•H2O,
按pH由大到小顺序排列正确的是( )
| A. | ⑤①③②④ | B. | ④②③①⑤ | C. | ①⑤③②④ | D. | ①⑤③④② |
分析 根据溶液的酸碱性以及利用盐类的水解程度来确定溶液中pH大小,如:①碱性溶液的pH>、酸性溶液的pH<7,中性溶液的pH=7;②酸的酸性越弱则酸的酸根离子水解程度越大,其相同浓度钠盐溶液的pH越大,据此进行判断.
解答 解:①CH3COONa是强碱弱酸盐,其溶液呈碱性,pH>7;
②NH4Cl强酸弱碱盐,铵根离子水解而使其溶液呈弱酸性,pH<7;
③Na2SO4是强酸强碱盐,其溶液呈中性,pH=7;
④NaHSO4是强酸酸式盐,硫酸氢根离子能完全电离生成氢离子,导致其溶液呈强酸性,其酸性比硝酸铵强,即pH比硝酸铵小;
⑤NH3•H2O是弱碱,其溶液呈碱性,pH>7,相同物质的量浓度时,其碱性比NaClO强,即其pH比NaClO大;
所以这几种溶液pH大小顺序是⑤>①>③>②>④,
故选A.
点评 本题考查了pH大小的判断,题目难度不大,先根据溶液的酸碱盐大体分类,再根据弱离子的水解浓度判断pH大小,注意硫酸氢根离子和碳酸氢根离子在水溶液里电离方式不同,为易错点.

练习册系列答案
相关题目
19.在氧化还原反应中,氧化剂的氧化性比氧化产物强,还原剂的还原性比还原产物强,已知X2、Y2、Z2、W2四种物质的氧化性强弱顺序为:W2>Z2>X2>Y2,则下列氧化还原反应能发生的是( )
| A. | 2W-+Z2═W2+2Z- | B. | 2Y-+W2═Y2+2W- | C. | 2Z-+X2═Z2+2X- | D. | 2X-+Y2═X2+2Y- |
20.下列反应一定属于吸热反应的是( )
| A. | 酸碱中和反应 | B. | 氯酸钾分解为氧气和氯化钾的反应 | ||
| C. | 物质燃烧反应 | D. | 实验室制H2的反应 |
17.下列对有机物结构或性质的描述,错误的是( )
| A. | 苯分子中的6个碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间的独特的键 | |
| B. | 将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| D. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
4.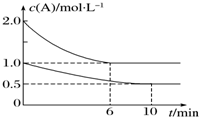 在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )
在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )
 在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )
在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )| A. | 甲和乙中A的平衡转化率相等 | |
| B. | 给甲容器加压可缩短反应达到平衡的时间 | |
| C. | 给乙容器升温可缩短反应达到平衡的时间 | |
| D. | 甲容器中A的反应速率为0.1 mol•L-1•min-1 |
14.相同温度、相同浓度的六种电解质溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别是( )
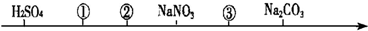
| A. | CH3COOH HCl CH3COONa | B. | HCl CH3COOH NaHCO3 | ||
| C. | NH4Cl CH3COOH NaOH | D. | NH4Cl HCl CH3COONa |
1.将下列各组物质按酸、碱、盐分类顺序排列,其中正确的是( )
| A. | 盐酸、苛性钠、偏铝酸钠 | B. | 硅酸、乙醇、小苏打 | ||
| C. | 硫酸、纯碱、硅酸钠 | D. | 碳酸、烧碱、一水合氨 |