题目内容
16.下列说法不正确的是( )| A. | 向Na2CO3溶液中逐滴加入HCl,直到不再生成CO2气体为止,在此过程中,溶液中HCO3-的浓度变化是先变大后变小(溶液体积变化均忽略不计) | |
| B. | 向NaHCO3溶液中加入Ba(OH)2固体,CO32-的浓度变化是先变大后变小(溶液体积变化均忽略不计) | |
| C. | 有含0.2molNa2CO3和含0.3molHCl的两种溶液:①将Na2CO3溶液逐滴滴入HCl溶液中;②将HCl溶液逐滴滴入Na2CO3溶液中.①②两种操作生成CO2的体积之比为3:2 | |
| D. | 将等质量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a、b的关系是a=b |
分析 A.碳酸根离子中逐渐滴入氯化氢,碳酸根离子先与氢离子反应生成碳酸氢根离子,然后碳酸氢根离子再与氢离子反应生成二氧化碳和水;
B.向NaHCO3溶液中加入Ba(OH)2固体,二者反应先生成碳酸钡、碳酸钠和水,再加氢氧化钡则发生碳酸钠与氢氧化钡的反应生成碳酸钡沉淀;
C.将Na2CO3溶液逐滴滴入HCl溶液中,盐酸过量,立即产生二氧化碳气体,发生反应:CO32-+2H+=H2O+CO2↑;依据二者物质的量可知生成二氧化碳气体的物质的量为0.15mol;将HCl溶液逐滴滴入Na2CO3溶液中,先发生反应:CO32-+H+=HCO3-,根据二者物质的量可知生成0.2mol碳酸氢根离子,继续滴加盐酸,碳酸氢根离子与氢离子反应生成二氧化碳和水,发生反应:HCO3-+H+=CO2↑+H2O,依据剩余盐酸的量可计算生成二氧化碳物质的量为0.1mol;
D.根据方程式:Na2O+H2O=2NaOH、2Na2O2+2H2O=4NaOH+O2↑结合质量分数浓度解答.
解答 解:A.碳酸根离子中逐渐滴入氯化氢,碳酸根离子先与氢离子反应生成碳酸氢根离子,然后碳酸氢根离子再与氢离子反应生成二氧化碳和水,所以在此过程中,溶液中HCO3-的浓度变化是先变大后变小,故A正确;
B.向NaHCO3溶液中加入Ba(OH)2固体,二者反应先生成碳酸钡、碳酸钠和水,此时碳酸根离子增加,再加氢氧化钡则发生碳酸钠与氢氧化钡的反应生成碳酸钡沉淀,碳酸根离子浓度减小,所以CO32-的浓度变化是先变大后变小,故B正确;
C.将Na2CO3溶液逐滴滴入HCl溶液中,盐酸过量,立即产生二氧化碳气体,发生反应:CO32-+2H+=H2O+CO2↑;依据二者物质的量可知生成二氧化碳气体的物质的量为0.15mol;将HCl溶液逐滴滴入Na2CO3溶液中,先发生反应:CO32-+H+=HCO3-,根据二者物质的量可知生成0.2mol碳酸氢根离子,继续滴加盐酸,碳酸氢根离子与氢离子反应生成二氧化碳和水,发生反应:HCO3-+H+=CO2↑+H2O,依据剩余盐酸的量可计算生成二氧化碳物质的量为0.1mol,所以.①②两种操作生成CO2的体积之比为0.15mol:0.1mol=3:2,故C正确;
D.等质量的Na2O和Na2O2样品分别放入等量的水中,氧化钠与水反应消耗的水和生成的氢氧化钠的量大于过氧化钠与水反应消耗的水和生成的氢氧化钠的量,因此氧化钠与水反应所得溶液的质量分数大,故D错误;
故选:D.
点评 本题考查了有关方程式计算,明确发生反应的先后顺序是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 由2H和18O所组成的水11g,其中所含的中子数为5NA | |
| B. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| C. | 常温常压下,48gO2和O3混合气含有的氧原子数为3NA | |
| D. | 100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子数均约为0.2NA |
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| C. | 若M+和R2-的核外电子层结构相同,则原子序数:R<M | |
| D. | 主族元素的最高正化合价等于该元素原子的核外电子数 |
| A. | 4克H2 | B. | 3.01×1023个O2 | C. | 0.8mo1NH3 | D. | 4克NaOH |
| X | Y | ||
| Z | W | Q |
| A. | X有多种同素异形体,而Y不存在同素异形体 | |
| B. | 由Z与Y组成的物质在熔融时能导电 | |
| C. | 单质的沸点:W<Q | |
| D. | 钠与Y可能形成Na2Y2化合物 |
| A. | 反应开始时速率:甲=乙 | B. | 反应所需时间:乙>甲 | ||
| C. | 参加反应时锌的质量:甲=乙 | D. | 两份酸溶液物质的量浓度:乙>甲 |
 ,有关该元素的说法中,错误的是( )
,有关该元素的说法中,错误的是( )| A. | 原子的核内质子数为17 | B. | 原子的核外有3个电子层 | ||
| C. | 原子的最外层电子数为7 | D. | 属于金属元素 |
| A. | 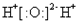 | B. | Cl:Cl | C. | 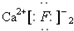 | D. |  |
| A. | 原子的最外层电子数等于电子层数 | |
| B. | 反应中可失去三个电子,比镁、钠还原性弱 | |
| C. | 失去电子的铝离子半径比铝原子小 | |
| D. | 铝离子比镁离子、钠离子的半径大 |