题目内容
11.短周期元素X、Y、Z、W、Q在元素周期表的位置如下表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是( )| X | Y | ||
| Z | W | Q |
| A. | X有多种同素异形体,而Y不存在同素异形体 | |
| B. | 由Z与Y组成的物质在熔融时能导电 | |
| C. | 单质的沸点:W<Q | |
| D. | 钠与Y可能形成Na2Y2化合物 |
分析 X元素原子的内层电子数是最外层电子数的一半,X原子只能有2个电子层,最外层电子数为4,则X为C元素;由元素在周期表中的位置可知,Y为O、Z为Si、W为S、Q为Cl,以此解答该题.
解答 解:X元素原子的内层电子数是最外层电子数的一半,X原子只能有2个电子层,最外层电子数为4,则X为碳元素;由元素在周期表中的位置可知,Y为O、Z为Si、W为S、Q为Cl,
A.Y为O,氧元素存在O2、O3等在同素异形体,故A错误;
B.Y为O、Z为Si,二者形成二氧化硅,二氧化硅为共价化合物,熔融状态不导电,故B错误;
C.W为S、Q为Cl,常温下S单质为固态,S单质为固态,说明S单质的熔沸点大于氯气,故C错误;
D.Y为O元素,钠与氧可能形成化合物Na2O2,故D正确;
故选D.
点评 本题考查结构性质位置关系应用,为高频考点,题目难度不大,确定X是解题关键,注意掌握元素周期表的结构及元素周期律,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.某元素X的最高正化合价为+7价,下面的叙述不正确的是( )
| A. | 该元素的原子最外层上有7个电子 | |
| B. | 该元素最高价氧化物的化学式为XO3 | |
| C. | 该元素位于ⅦA族 | |
| D. | 该元素最高价氧化物对应水化物的化学式为HXO4 |
2.仪器名称为“容量瓶”的是( )
| A. |  | B. |  | C. |  | D. |  |
19.已知HA、H2B为二种弱酸,HA的电离常数为KHA,H2B的电离常数为K1、K2,其大小依次是K1>KHA>K2,由此可以推测以下各反应中不能进行的是( )
| A. | NaA+H2B→NaHB+HA | B. | 2NaA+H2B→Na2B+2HA | ||
| C. | NaHB+HA→NaA+H2B | D. | Na2B+HA→NaHB+NaA |
6.含下列某种杂质的氯化钠样品,经测定氯的质量分数为62.0%,则该样品中含有的杂质可能是( )
| A. | MgCl2 | B. | ZnCl2 | C. | BaCl2 | D. | KCl |
16.下列说法不正确的是( )
| A. | 向Na2CO3溶液中逐滴加入HCl,直到不再生成CO2气体为止,在此过程中,溶液中HCO3-的浓度变化是先变大后变小(溶液体积变化均忽略不计) | |
| B. | 向NaHCO3溶液中加入Ba(OH)2固体,CO32-的浓度变化是先变大后变小(溶液体积变化均忽略不计) | |
| C. | 有含0.2molNa2CO3和含0.3molHCl的两种溶液:①将Na2CO3溶液逐滴滴入HCl溶液中;②将HCl溶液逐滴滴入Na2CO3溶液中.①②两种操作生成CO2的体积之比为3:2 | |
| D. | 将等质量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a、b的关系是a=b |
3.下列与化学概念有关的说法正确的是( )
| A. | 化合反应均为氧化还原反应 | B. | 金属氧化物均为碱性氧化物 | ||
| C. | 烧碱、纯碱、熟石灰都是碱 | D. | BaSO4、NaOH、HNO3都是强电解质 |
1.下列叙述不正确的是( )
| A. | 化学反应释放或吸收能量的多少与发生反应的反应物的物质的量有关 | |
| B. | 人们可以利用氧化还原反应设计原电池以获取电能 | |
| C. | 人们可以利用C2H2(乙炔)与O2的化学反应获取热能或电能或光能 | |
| D. | MnO4-+5e-+8H+═Mn2++4H2O可能是某原电池里的负极反应 |
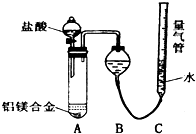 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.