题目内容
1.pH相同的两份溶液(甲:盐酸,乙:醋酸)分别于锌粒反应,若最后锌都完全溶解,且放出气体一样多,那么下列判断不正确的是( )| A. | 反应开始时速率:甲=乙 | B. | 反应所需时间:乙>甲 | ||
| C. | 参加反应时锌的质量:甲=乙 | D. | 两份酸溶液物质的量浓度:乙>甲 |
分析 A.pH相同的盐酸(甲)和醋酸(乙),则两种溶液中氢离子浓度相等,反应速率和离子浓度成正比;
B.盐酸中的氢离子浓度小于醋酸中氢离子浓度,则盐酸反应速率小于醋酸;
C.生成氢气的量相等,根据电子守恒可知消耗锌的质量相等;
D.醋酸是弱电解质,氯化氢是强电解质,所以c(HCl)<c(CH3COOH).
解答 解:A.pH相同的盐酸(甲)和醋酸(乙),两种溶液中氢离子浓度相等,所以开始反应速率相等,甲=乙,故A正确;
B.反应过程中,醋酸电离导致醋酸中氢离子浓度减少速率小于盐酸中氢离子浓度减少速率,盐酸中的氢离子浓度小于醋酸中氢离子浓度,盐酸反应速率小于醋酸,所以反应所需时间为:甲>乙,故B错误;
C.两溶液反应后放出气体一样多,根据电子守恒,消耗Zn的质量一定相等,故C正确;
D.pH相同的盐酸(甲)和醋酸(乙),醋酸是弱电解质,氯化氢是强电解质,所以c(HCl)<c(CH3COOH),即乙>甲,故D正确;
故选B.
点评 本题考查弱电解质的电离特点,题目难度不大,明确电离平衡及其影响为解答关键,A为易错点,注意反应速率与氢离子浓度大小有关,试题培养了学生的灵活应用能力.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
11.下列有关物质性质的应用正确的是( )
| A. | Na2CO3的水溶液呈碱性,医学上能用作治疗胃酸过多 | |
| B. | 明矾溶于水能形成胶体,可用于自来水的杀菌消毒 | |
| C. | Na2O2能分别与H2O、CO2反应,可用作供氧剂 | |
| D. | 金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti |
12.深蓝色的硫酸四氨合铜晶体受热分解的化学方程式为:3[Cu(NH3)4]SO4•H2O$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+8NH3↑+2N2↑+3SO2↑+9H2O,下列分析正确的是( )
| A. | 1mol[Cu(NH3)4]SO4•H2O分解产生气体体积为97.1L | |
| B. | 生成1molCu转移2mol电子 | |
| C. | 分解产生的气体通入BaCl2溶液有白色沉淀生成 | |
| D. | 可以用湿润的红色石蕊试纸直接检验此反应产生的氨气 |
16.下列说法不正确的是( )
| A. | 向Na2CO3溶液中逐滴加入HCl,直到不再生成CO2气体为止,在此过程中,溶液中HCO3-的浓度变化是先变大后变小(溶液体积变化均忽略不计) | |
| B. | 向NaHCO3溶液中加入Ba(OH)2固体,CO32-的浓度变化是先变大后变小(溶液体积变化均忽略不计) | |
| C. | 有含0.2molNa2CO3和含0.3molHCl的两种溶液:①将Na2CO3溶液逐滴滴入HCl溶液中;②将HCl溶液逐滴滴入Na2CO3溶液中.①②两种操作生成CO2的体积之比为3:2 | |
| D. | 将等质量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a、b的关系是a=b |
13.若元素X、Y是同主族,X元素最高价氧化物对应水化物的碱性比Y强,下列有关X、Y元素及其单质和化合物的性质判断正确的是( )
| A. | 原子半径:X>Y | |
| B. | 失电子能力:X<Y | |
| C. | 对应简单离子的氧化性:X>Y | |
| D. | X元素的单质跟酸反应置换出氢气比Y容易 |
10.下列用来表示物质变化的化学用语中,正确的是( )
| A. | 碱性氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- | |
| B. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ | |
| C. | 用惰性电极分别电解熔融氯化钠和饱和食盐水时,阳极的电极反应式均为:2Cl--2e-=Cl2↑ | |
| D. | 钢铁发生吸氧腐蚀时的正极反应式:Fe-2e-=Fe2+ |
4.下列物质中,含有离子键的是( )
| A. | H2 | B. | HCl | C. | NaCl | D. | CO2 |
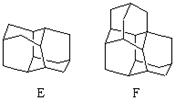 在石油中存在一种有机分子(D),X-射线衍射技术测得其结构高度对称,分子中碳原子的排列方式相当于金刚石晶胞中的部分碳原子排列,故D俗称金刚烷.图给出两种由2,3个D为基本结构单元“模块”像搭积木一样“搭”成的较复杂笼状烷的结构式.金刚烷(D)的结构式为
在石油中存在一种有机分子(D),X-射线衍射技术测得其结构高度对称,分子中碳原子的排列方式相当于金刚石晶胞中的部分碳原子排列,故D俗称金刚烷.图给出两种由2,3个D为基本结构单元“模块”像搭积木一样“搭”成的较复杂笼状烷的结构式.金刚烷(D)的结构式为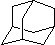 ,其中碳原子的杂化方式为sp3杂化,E的分子式为C14H20.在星际云中也发现一种高度对称的有机分子,分子式为(CH2)6N4,结构类似于金刚烷,俗称四氮金刚烷,它和金刚烷互为C(填标号).
,其中碳原子的杂化方式为sp3杂化,E的分子式为C14H20.在星际云中也发现一种高度对称的有机分子,分子式为(CH2)6N4,结构类似于金刚烷,俗称四氮金刚烷,它和金刚烷互为C(填标号).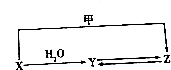 有机物X、Y、Z的转化关系如图所示(化学反应条件已省略),又己知X的储量是衡量一个国家石油化工发展水平的标志,甲是空气的主要成分之一,Y是一种常用的液体燃料.
有机物X、Y、Z的转化关系如图所示(化学反应条件已省略),又己知X的储量是衡量一个国家石油化工发展水平的标志,甲是空气的主要成分之一,Y是一种常用的液体燃料.