题目内容
2.为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇.一定条件下发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H<0.(1)在一定条件下,在20L密闭容器中按物质的量比为1:3充入CO2和H2,温度在450K,n(H2)随时间变化如下表所示:
| t/min | 0 | 1 | 3 | 5 |
| N(H2)/mol | 8 | 6 | 5 | 5 |
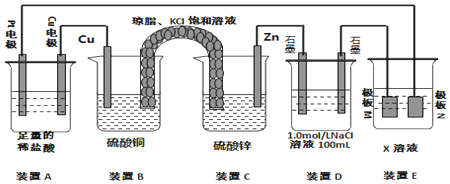
(2)在5MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图所示:曲线乙表示的是CO2(填物质的化学式)的体积分数,图象中A点对应的体积分数b=18.8%(结果保留三位有效数字).
(3)下列措施中能使化学平衡向正反应方向移动的是BD
A.升高温度 B.将CH3CH2OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3molH2
(4)25℃,1.01×105Pa时,9.2g液态乙醇完全燃烧,当恢复到原状态时,放出273.4kJ的热量,写出表示乙醇燃烧的热化学方程式:CH3CH2OH(l)+3O2(g)═CO2(g)+2H2O(l)△H=-1367kJ•mol-1.
(5)以石墨为电极,氢氧化钠、乙醇、水、氧气为原料,可以制成乙醇的燃料电池,写出发生还原反应的电极反应式:O2+2H2O+4e-═4OH?.
分析 (1)根据图求出0~1min,υ(H2)=$\frac{\frac{8-6}{20}}{1}$=0.1mol•(L•min)-1,然后根据速率之比等于对应物质的化学计量数之比,平衡常数等于平衡时生成物浓度幂之积比反应物浓度幂之积,由此分析解答;
(2)反应为放热反应,升高温度平衡向逆反应移动,平衡时CO2与H2的含量增大,开始n(H2)/n(CO2)=3,H2与CO2反应按3:1进行,平衡时H2的含量是CO2的含量三倍,平衡时H2的含量比二氧化碳高;平衡时CH3CH2OH(g)、H2O(g)的含量降低,CH3CH2OH与H2O按1:3反应,平衡时H2O的含量是CH3CH2OH含量的三倍,平衡时H2O的含量高;由①方向可知,图中曲线乙和丙的交点A表示平衡时CO2、H2O的含量相等,令H2与CO2的起始物质的量分别为3mol、1mol,设平衡时乙醇的物质的量为xmol,利用三段式表示出平衡时各组分的物质的量,再根据CO2、H2O的含量相对列方程计算解答;
(3)A.正反应是放热反应,升高温度平衡逆向移动;
B.将CH3CH2OH(g)及时液化抽出,减少生成物的浓度平衡正向移动;
C.选择高效催化剂,平衡不移动;
D.再充入l molCO2和3molH2,相当于增大压强,平衡正向移动;
(4)9.2g液态乙醇完全燃烧,当恢复到原状态时,放出273.4kJ的热量,则1mol 液态乙醇完全燃烧,当恢复到原状态时,放出1367kJ的热量,据此书写;
(5)正极氧气发生还原反应,电极反应式为:O2+2H2O+4e-═4OH?.
解答 解:(1)根据图求出0~1min,υ(H2)=$\frac{\frac{8-6}{20}}{1}$=0.1mol•(L•min)-1,所以υ(CH3CH2OH)=$\frac{1}{6}×0.1$=0.0167mol/(L•min),
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)
c(初起):$\frac{4}{30}$ 0.4 0 0
c(变化):0.05 0.15 0.025 0.075
c(平衡):0.08 0.25 0.025 0.075
K=$\frac{0.07{5}^{3}×0.025}{0.0{8}^{2}×0.2{5}^{6}}$=6.22,
故答案为:0.0167mol/(L•min);6.22;
(2)反应为放热反应,升高温度平衡向逆反应移动,平衡时CO2与H2的含量增大,开始n(H2)/n(CO2)=3,H2与CO2反应按3:1进行,平衡时H2的含量是CO2的含量三倍,平衡时H2的含量比二氧化碳高,平衡时CH3CH2OH(g)、H2O(g)的含量降低,CH3CH2OH与H2O按1:3反应,平衡时H2O的含量是CH3CH2OH含量的三倍,平衡时H2O的含量高;曲线甲、曲线乙随温度升高含量增大,且曲线Ⅰ的含量高,所以曲线甲表示H2、曲线乙表示CO2,曲线丙、曲线丁随温度升高含量减小,且曲线丙的含量高,所以曲线丙表示H2O、曲线丁表示CH3CH2OH,2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g);
由①方向可知,图中曲线Ⅱ和Ⅲ的交点a表示平衡时CO2、H2O的含量相等,令H2与CO2的起始物质的量分别为3mol、1mol,设平衡时乙醇的物质的量为xmol,则:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)
开始(mol):1 3 0 0
变化(mol):2x 6x x 3x
平衡(mol):1-2x 3-6x x 3x
故1-2x=3x,解得x=0.2
故图中曲线乙和丙的交点A对应的体积分数b=$\frac{3x}{1-2x+3-6x+x+3x}$×100%=$\frac{3x}{4-4x}$×100%=$\frac{3×0.2}{4-4×0.2}$×100%=18.8%,
故答案为:CO2;18.8;
(3)A.正反应是放热反应,升高温度平衡逆向移动,故不符合;
B.将CH3CH2OH(g)及时液化抽出,减少生成物的浓度平衡正向移动,故符合;
C.选择高效催化剂,平衡不移动,故不符合;
D.再充入l molCO2和3molH2,相当于增大压强,平衡正向移动,故符合;
故选:BD;
(4)9.2g液态乙醇完全燃烧,当恢复到原状态时,放出273.4kJ的热量,则1mol 液态乙醇完全燃烧,当恢复到原状态时,放出1367kJ的热量,所以热化学方程式为:CH3CH2OH(l)+3O2(g)═CO2(g)+2H2O(l)△H=-1367kJ•mol-1,
故答案为:CH3CH2OH(l)+3O2(g)═CO2(g)+2H2O(l)△H=-1367kJ•mol-1;
(5)正极氧气发生还原反应,电极反应式为:O2+2H2O+4e-═4OH?,故答案为:O2+2H2O+4e-═4OH?.
点评 本题目综合考查化学反应速率和化学平衡移动的影响因素以及有关化学平衡的转化率、平衡常数的计算等方面的知识,题目难度中等,注意明确影响化学反应速率、化学平衡的因素,掌握化学平衡常数的概念及计算方法.

 53随堂测系列答案
53随堂测系列答案
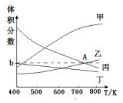
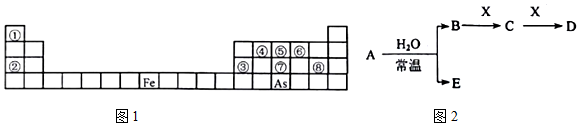
(1)固体I中主要成分为CaCO3、CaSO3、Ca(OH)2,捕获剂所捕获的气体主要是CO.
(2)处理含NH4+废水时,发生反应的离子方程式为NH4++NO2-=N2↑+2H2O.
(3)若X为适量空气,严格控制空气用量的原因是过量空气会将NO氧化成NO3-,无法与NH4+发生反应.
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol•L-1.反应一段时间后溶液中离子浓度的分析结果如表:
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
增加压强,NO的转化率提高(填“提高”、“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐减小(填“增大”、“不变”或“减小”).
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果.从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是Ca2+与SO42-结合生成CaSO4沉淀,使平衡向产物方向移动,SO2转化率提高.
| A. | 纳米铁粉可以高效地去除被污染水体中的 Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附 | |
| B. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| C. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| D. | 火力发电中,燃烧是使化学能转换为电能的关键 |
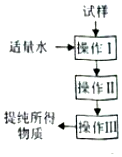 实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )
实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )| A. | 操作I一定是过滤,其目的是将固液分离 | |
| B. | 可以提纯含少量氧化铁杂质的氧化铝 | |
| C. | 可以提纯含少量氯化钠杂质的硝酸钾 | |
| D. | 可以提纯含少量碘杂质的氧化钠 |
 合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.
合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2?2NH3.该可逆反应达到平衡的标志是C;
A.3v(H2)正=2v(NH3)逆
B.单位时间生成mmolN2的同时生成3mmolH2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
(2)氨气具有还原性,例如,氨气能与卤素单质发生置换反应.已知几种化学键的键能数据如表所示:
请写出氨气与溴蒸汽反应的热化学方程式2NH3 (g)+3Br2(g)=N2(g)+6HBr(g)△H=-214KJ/mol;
| 化学键 | N-H | N≡N | Br-Br | H-Br |
| 键能/kJ•mol-1 | 391 | 946 | 194 | 366 |
| 时间/min | CH4(mol) | H2O(mol) | CO (mol) | H2 (mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
②该温度下,上述反应的平衡常数K=0.0675;
③反应在7-10min内,CO的物质的量减少的原因可能是D(填字母)
A.减少CH4的物质的量 B.降低温度 C.升高温度 D.充入H2
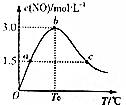
(4)氨的催化氧化:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)是工业制硝酸的重要反应.在1L密闭容器中充入4molNH3(g)和5molO2(g),保持其他条件不变,测得c(NO)与温度的关系如图所示.该反应的△H<0(填“>”、“<”
或“=”);T0温度下,NH3的转化率为75%.
| A. | $\frac{mω}{28V}$mol•L-1 | B. | $\frac{mω}{56V}$ mol•L-1 | C. | $\frac{mω}{112V}$mol•L-1 | D. | $\frac{mω}{V}$ mol•L-1 |
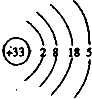 ;其氢化物的化学式为AsH3.
;其氢化物的化学式为AsH3.