题目内容
16.下列说法正确的是( )| A. | PH=10的Mg(OH)2浊液C(Mg2+)=10-8 mol•L-1 (已知Mg(OH)2KSP=1×10-16) | |
| B. | 已知AgClKSP=1.8×10-10;Ag2CrO4KSP=1.2×10-12则AgCl的溶解度一定比Ag2CrO4大 | |
| C. | 在饱和AgCl溶液中加入NaI固体不会发生变化 | |
| D. | Fe3+在酸性溶液中一定不会生成Fe(OH)3沉淀 |
分析 A、PH=10的Mg(OH)2浊液,c(OH-)=10-4mol/L,根据Ksp=c(Mg2+)•c2(OH-)计算;
B、设AgCl溶解的浓度为xmol/L,则溶液中的银离子浓度为xmol/L,氯离子也为xmol/L,则根据溶度积为1.8×10-10 mol2•L-2可以计算出x;同理可以设Ag2CrO4溶解的浓度为ymol/L,则溶液中的银离子浓度为2ymol/L,氯离子也为ymol/L,再根据溶度积为1.2×10-12 mol3•L-3计算出y,比较x和y即可解答;
C、在饱和AgCl溶液中加入NaI固体,生成黄色沉淀;
D、铁离子在强酸性溶液中能稳定存在,弱酸性溶液中转化为氢氧化铁沉淀.
解答 解:A、PH=10的Mg(OH)2浊液,c(OH-)=10-4mol/L,根据Ksp=c(Mg2+)•c2(OH-),所以c(Mg2+)=$\frac{1×1{0}^{-16}}{1{0}^{-8}}$=10-8 mol•L-1,故A正确;
B、设AgCl溶解的浓度为xmol/L,则溶液中的银离子浓度为xmol/L,氯离子也为xmol/L,则根据溶度积为1.8×10-10=x×x,解得x=1.35×10-5mol/L
同理设Ag2CrO4溶解的浓度为ymol/L,则溶液中的银离子浓度为2ymol/L,氯离子也为ymol/L,再根据溶度积为1.2×10-12=(2y)2×y,解得y=0.8×10-4mol/L,故溶解度较小的物质是AgCl,故溶度积小的溶解度反而大,所以Ksp的大小与溶解能力没有一定的关系,故B错误;
C、在饱和AgCl溶液中加入NaI固体,生成溶度积极小的黄色碘化银沉淀,故C错误;
D、铁离子在强酸性溶液中能稳定存在,弱酸性溶液中转化为氢氧化铁沉淀,故D错误;
故选A.
点评 本题考查难溶电解质的溶解平衡,本题难度中等,比较溶解度大小,若用溶度积必须是同类型,否则不能比较.

 导学教程高中新课标系列答案
导学教程高中新课标系列答案| A. | CO2属于温室气体 | |
| B. | 太阳能电池可将太阳能转化为电能 | |
| C. | 太阳能、风能和生物能源属于新能源 | |
| D. | 乙醇属不可再生能源,乙醇燃烧不会产生温室气体 |
| A. | 锅炉水垢中的CaSO4经饱和碳酸钠溶液浸泡可转化为CaCO3 | |
| B. | 常温下,在含有Ag+和Cl-的溶液中,Ag+和Cl-浓度之积是个常数 | |
| C. | 当醋酸达到电离平衡后,改变某条件电离平衡向正反应方向移动,则溶液的导电能力一定变强 | |
| D. | 将浓度为0.1 mol/L的HF溶液加水不断稀释,溶液$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02 mol•L-1AgNO3溶液和0.02 mol•L-1 Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL 0.1 mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
| A. | 常温下,向含有AgCl固体的饱和溶液,加少量水稀释,c(Ag+)和Ksp(AgCl)均保持不变 | |
| B. | pH=5的CH3COOH与CH3COONa的混合溶液中:c(Na+)>c(CH3COO-) | |
| C. | 将0.2mol/LCH3COOH溶液和0.1mol/LNaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) | |
| D. | 将水加热煮沸,能促进水的电离,Kw增大,pH增大,溶液呈碱性 |
| A. | 达到平衡时,c(Pb2+)=c(Fe2+) | |
| B. | Ksp(FeS)大于Ksp(PbS) | |
| C. | 该反应的平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(PbS)}$ | |
| D. | 溶液中加入少量Na2S固体后,c(Fe2+)减小 |
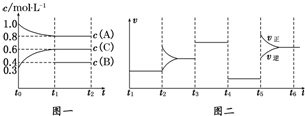
(1)若t1=15min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=0.02 mol/(L•min).
(2)t4~t5阶段改变的条件为减小压强,B的起始物质的量为1.0 mol.各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)?3C(g)△H=+200a kJ/mol.
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为a+$\frac{2}{3}$c=2.4,b+$\frac{1}{3}$c=1.2.