题目内容
6.下列反应中,最终能生成+3价铁的化合物的是( )①铁粉和稀盐酸②过量铁和稀硝酸③过量铁和FeCl3④氯水和FeCl2⑤FeO和稀硝酸⑥铁粉和足量稀硝酸 ⑦铁片投入CuSO4溶液⑧铁在Cl2中燃烧.
| A. | ②③④⑥ | B. | ④⑤⑥⑧ | C. | ③④⑥⑧ | D. | ②③⑤⑥ |
分析 铁的化合价有+2、+3价,铁、亚铁化合物可与强氧化剂反应+3价化合物,与弱氧化剂反应生成+2价,以此解答该题.
解答 解:①铁粉和稀盐酸生成氯化亚铁,故错误;
②过量铁和稀硝酸生成硝酸亚铁,故错误;
③过量铁和FeCl3生成氯化亚铁,故错误;
④氯水和FeCl2生成氯化铁,故正确;
⑤FeO和稀硝酸反应生成生成硝酸铁,故正确;
⑥铁粉和足量稀硝酸生成硝酸铁,故正确;
⑦铁片投入CuSO4溶液生成硫酸亚铁,故错误;
⑧铁在Cl2中燃烧生成氯化铁,故正确.
故选B.
点评 本题考查铁及其化合物转化的有关判断,该题是高考中的常见题型和考点,属于中等难度的试题,试题基础性强,主要是考查学生对铁及其化合物转化的熟悉了解程度,有利于巩固学生的基础知识,提高学生灵活运用基础知识解决实际问题的能力,也有利于培养学生的逻辑推理能力和灵活应变能力.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | PH=10的Mg(OH)2浊液C(Mg2+)=10-8 mol•L-1 (已知Mg(OH)2KSP=1×10-16) | |
| B. | 已知AgClKSP=1.8×10-10;Ag2CrO4KSP=1.2×10-12则AgCl的溶解度一定比Ag2CrO4大 | |
| C. | 在饱和AgCl溶液中加入NaI固体不会发生变化 | |
| D. | Fe3+在酸性溶液中一定不会生成Fe(OH)3沉淀 |
14.12mL浓度为0.10mol•L-1的Na2SO3溶液,恰好与10mL浓度为0.04mol?L-1的K2Cr2O7溶液完全反应,已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
| A. | +5 | B. | +4 | C. | +3 | D. | +2 |
11.下列关于Fe(OH)3胶体的说法正确的是( )
| A. | Fe(OH)3胶体带正电荷,因此能发生电泳现象 | |
| B. | Fe(OH)3胶体与FeCl3溶液的本质区别是胶体粒子直径在1-100nm之间 | |
| C. | 将FeCl3溶液加入到沸水中能制得Fe(OH)3胶体 | |
| D. | Fe(OH)3胶体和CuSO4溶液都能发生丁达尔现象 |
18.已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2═HCN+NaNO2
NaCN+HF═HCN+NaF
NaNO2+HF═HNO2+NaF
由此可判断下列叙述不正确的是( )
NaCN+HF═HCN+NaF
NaNO2+HF═HNO2+NaF
由此可判断下列叙述不正确的是( )
| A. | K(HF)=7.2×10-4 | |
| B. | K(HNO2)=4.9×10-10 | |
| C. | 根据其中两个反应即可得出三种酸对应的电离常数 | |
| D. | K(HCN)<K(HNO2)<K(HF) |
15.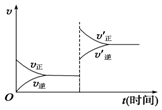 对于达到平衡的可逆反应:X+Y?W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )
对于达到平衡的可逆反应:X+Y?W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )
 对于达到平衡的可逆反应:X+Y?W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )
对于达到平衡的可逆反应:X+Y?W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )| A. | Z、W为气体,X、Y中之一为气体 | B. | Z、W中之一为气体,X、Y为非气体 | ||
| C. | X、Y、Z皆为气体,W为非气体 | D. | X、Y、Z、W皆为气体 |