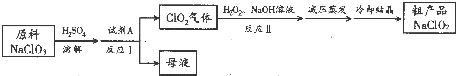
题目内容
15.下列叙述正确的有几项( )①NH3溶于水能导电,所以NH3是电解质
②BaSO4投入水中,导电性较弱,故它是弱电解质
③氯化氢水溶液能导电,所以氯化氢是电解质
④氯化钠溶液能导电,所以氯化钠溶液是电解质
⑤硫磺(S)不能导电,所以硫磺是非电解质
⑥CaCO3投入水中几乎不能导电,但CaCO3是强电解质.
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
分析 ①NH3溶于水能导电和其本身无关;
②BaSO4投入水中能完全电离;
③在水溶液中或熔融状态下能导电的化合物为电解质;
④氯化钠溶液是混合物;
⑤单质既不是电解质也不是非电解质;
⑥强弱电解质的本质区别是能否完全电离.
解答 解:①NH3溶于水生成一水合氨,故氨水能导电和氨气本身无关,即氨气为非电解质,故错误;
②强弱电解质的本质区别是能否完全电离,而BaSO4投入水中能完全电离,故为强电解质,故错误;
③在水溶液中或熔融状态下能导电的化合物为电解质,由于盐酸能导电,故HCl为电解质,故正确;
④氯化钠溶液是混合物,故既不是电解质也不是非电解质,故错误;
⑤单质既不是电解质也不是非电解质,故硫单质不是电解质也不是非电解质,故错误;
⑥强弱电解质的本质区别是能否完全电离,CaCO3投入水中几乎不能导电,但能完全电离,故为强电解质,故错误.
故选A.
点评 本题考查了电解质、非电解质、强弱电解质的有关概念和区别,应注意的是强弱电解质的本质区别是能否完全电离,和溶解度无关.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
3.关于氯气的叙述中,下列不正确的是( )
| A. | 干燥的氯气可以贮存在钢瓶中 | |
| B. | 氯气是一种黄绿色的,强烈刺激性气味的有毒气体 | |
| C. | 工业上常用电解熔融氯化钠的方法制备氯气 | |
| D. | 氯气能给水进行消毒是因为氯气与水反应生成了HClO |
10.下列关于胶体的叙述中,不正确的是( )
| A. | 可用丁达尔效应区分溶液和胶体 | |
| B. | 将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 | |
| C. | Fe(OH)3胶体的电泳实验说明了胶体粒子带有电荷 | |
| D. | 江河入海口三角洲的形成,通常与胶体的性质有关 |
7.下列说法中,正确的是( )
| A. | 标准状况下,22.4 L水中含有6.02×1023个水分子 | |
| B. | 32 g氧气所含的原子数目为2×6.02×1023 | |
| C. | 常温常压下,0.5×6.02×1023个一氧化碳分子所占的体积是11.2 L | |
| D. | 1 molCaCl2溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1 mol/L |
4.50mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/L Al2(SO4)3溶液混合后(体积损失不计),溶液中SO42-的物质的量浓度约为( )
| A. | 0.35mol/L | B. | 0.45mol/L | C. | 0.5mol/L | D. | 0.6mol/L |
7.Ⅰ.验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
(1)写出上述实验中发生反应的化学方程式2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)实验结果表明,催化剂的催化效果与催化剂的颗粒大小有关.
Ⅱ.研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
(3)定性分析:如图甲可通过观察产生气泡的快慢,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
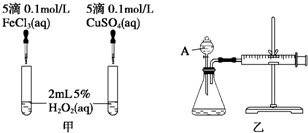
(4)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为分液漏斗,实验中需要测量的数据是收集40 mL气体所需要的时间.
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与催化剂的颗粒大小有关.
Ⅱ.研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
(3)定性分析:如图甲可通过观察产生气泡的快慢,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.

(4)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为分液漏斗,实验中需要测量的数据是收集40 mL气体所需要的时间.