题目内容
7.Ⅰ.验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与催化剂的颗粒大小有关.
Ⅱ.研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
(3)定性分析:如图甲可通过观察产生气泡的快慢,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
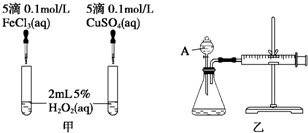
(4)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为分液漏斗,实验中需要测量的数据是收集40 mL气体所需要的时间.
分析 (1)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气;
(2)比较两个实验知,这两个实验只有催化剂表面积不同其它因素完全相同,导致两个实验中化学反应速率不同;
(3)探究Fe3+和Cu2+对H2O2分解的催化效果,必须保持其他的条件相同,所以将FeCl3改为Fe2(SO4)3更为合理,可以避免由于阴离子不同造成的干扰;
(4)该仪器是分液漏斗,催化效率越高,则一定时间内产生的气体越多.
解答 解:(1)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)比较两个实验知,这两个实验只有催化剂表面积不同其它因素完全相同,导致两个实验中化学反应速率不同,所以影响催化效果的是催化剂的颗粒大小,故答案为:催化剂的颗粒大小;
(3)在探究Fe3+和Cu2+对H2O2分解的催化效果是,必须保持其他的条件相同,所以将FeCl3改为Fe2(SO4)3更为合理,可以避免由于阴离子不同造成的干扰,
故答案为:反应产生气泡的快慢;控制阴离子相同,排除阴离子的干扰;
(4)由图可知,A为分液漏斗.定量比较Fe3+和Cu2+对H2O2分解的催化效果,可以通过测定产生40mL的气体所需的时间来比较.产生40mL的气体所需的时间越短,则催化效果越好,
故答案为:分液漏斗;收集40 mL气体所需要的时间.
点评 本题考查探究影响化学反应速率因素,侧重考查学生实验操作及实验分析、归纳总结能力,探究化学反应速率影响因素时必须只有一个因素不同其它因素必须完全相同,否则无法得出正确结论,如(3)将FeCl3改为Fe2(SO4)3更为合理,题目难度不大.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案| A. | 加催化剂 | B. | 升高温度 | C. | 减小压强 | D. | 加入O2 |
它可用于制备苯甲酸乙酯和苯甲酸铜.
(一)制备苯甲酸乙酯
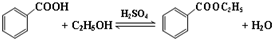
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |
实验流程如下:

(1)制备苯甲酸乙酯,下列装置最合适的是B,带“分水器”的冷凝回流装置与一般的冷凝装置相比,主要优点在于分离出生成的水,促进酯化反应向正向进行
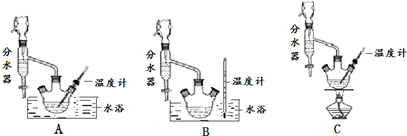
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是分水器中下层(水层)液面不再升高
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,加入无水MgSO4.乙醚的作用是萃取出水层中溶解的苯甲酸乙酯,提高产率
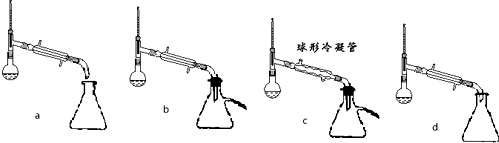
(5)步骤⑤蒸馏操作中,下列装置最好的是bd(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).
(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
(6)混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应,趁热过滤的原因为苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品.
(7)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是C
A.冷水 B.热水 C.乙醇 D.乙醇水混合溶液.

| A. | Ⅱ中主要反应的热化学方程式:S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1 | |
| B. | Ⅳ中主要反应的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3 | |
| C. | Ⅳ中使用催化剂可提高化学反应速率和平衡转化率 | |
| D. | Ⅴ中气体a 可以直接排放到大气中 |
| A. | 在一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| B. | 当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率 | |
| C. | 单位时间内生成CO和Cl2的物质的量比为1:1时,反应达到平衡状态 | |
| D. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| A. |  和 和 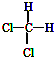 是两种种不同的物质 是两种种不同的物质 | |
| B. | 由乙烯之间的相互加成可以得到聚乙烯 | |
| C. | 丁烷与丁烯互为同系物 | |
| D. | 乙酸不能使紫色石蕊变红 |