题目内容
下列关于σ键和π键的理解不正确的是( )
| A、σ键能单独形成,而π键一定不能单独形成 |
| B、σ键可以绕键轴旋转,π键一定不能绕键轴旋转 |
| C、HCl 分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的 |
| D、气体单质中一定存在σ键,可能存在π键 |
考点:共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:A.单键为σ键,双键、三键中均含1个σ键;
B.σ键为球对称,π键为镜面对称;
C.HCl中为H的1s轨道与cl的3p轨道形成的s-pσ键;
D.稀有气体的单质中不存在共价键.
B.σ键为球对称,π键为镜面对称;
C.HCl中为H的1s轨道与cl的3p轨道形成的s-pσ键;
D.稀有气体的单质中不存在共价键.
解答:
解:A.分子中单键中只含σ键,双键和三键中含π键和σ键,所以π键一定不能单独形成,故A正确;
B.σ键为球对称,π键为镜面对称,则σ键可以绕键轴旋转,π键一定不能绕键轴旋转,故B正确;
C.H只有1s电子,Cl的3p轨道上的电子与H的1s轨道电子以“头碰头”方式重叠构建s-pσ键,故C正确;
D.稀有气体是单原子分子,分子中不存在共价键,所以稀有气体中没有σ键,所以多原子构成的气体单质中一定存在σ键,故D错误;
故选D.
B.σ键为球对称,π键为镜面对称,则σ键可以绕键轴旋转,π键一定不能绕键轴旋转,故B正确;
C.H只有1s电子,Cl的3p轨道上的电子与H的1s轨道电子以“头碰头”方式重叠构建s-pσ键,故C正确;
D.稀有气体是单原子分子,分子中不存在共价键,所以稀有气体中没有σ键,所以多原子构成的气体单质中一定存在σ键,故D错误;
故选D.
点评:本题考查共价键的形成及类型,注意σ键、π键的形成过程及判断的一般规律即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
某混合溶液中所含离子的浓度如下表,则M离子可能为( )
| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度/(mol?L-1) | 2 | 1 | 2 | 1 |
| A、Mg2+ |
| B、Ba2+ |
| C、Na+ |
| D、S2- |
下列实验误差分析错误的是( )
| A、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| B、用容量瓶配置溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| C、用湿润的pH试纸测稀碱液的pH,测定值偏小 |
| D、测定中和反应反的应热时,将碱液缓慢倒入酸中,所测温度值偏小 |
向四个体积相同的密闭容器(甲、乙、丙、丁)中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是( )
甲:在500℃时,10mol SO2和6mol O2反应
乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2反应
丙:在450℃时,8mol SO2和5mol O2反应
丁:在500℃时,8mol SO2和5mol O2反应.
甲:在500℃时,10mol SO2和6mol O2反应
乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2反应
丙:在450℃时,8mol SO2和5mol O2反应
丁:在500℃时,8mol SO2和5mol O2反应.
| A、甲、乙、丙、丁 |
| B、乙、甲、丙、丁 |
| C、乙、甲、丁、丙 |
| D、丁、丙、乙、甲 |
某溶液X含有K+、Mg2+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-中的几种,已知该溶液中各离子物质的量浓度均为0.1mol?L-1(不考虑水的电离及离子的水解).为确定该溶液中含有的离子,现进行了如下的操作:下列说法正确的是( )
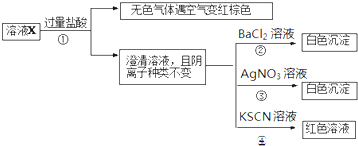

| A、无色气体可能是NO和CO2的混合物 |
| B、由步骤③可以确定原溶液中含有Cl- |
| C、溶液X中所含离子种类共有4种 |
| D、另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为1.2g |