题目内容
11. 2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1反应过程的能量变化如图所示.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1反应过程的能量变化如图所示.请回答下列问题:(1)图中A、C分别表示反应物总能量、生成物总能量,E的大小对该反应的反应热有无影响?无.该反应通常用催化剂,加催化剂后会使图中B点升高还是降低?降低,理由是催化剂能降低反应的活化能;
(2)已知单质硫的燃烧热为296KJ•mol-1,写出由S(s)生成SO3(g)的热化学方程式:S(s)+$\frac{3}{2}$O2(g)═SO3(g)△H=-395kJ•mol-1.
分析 (1)A、C分别表示反应物总能量的生成物总能量,B为活化能,活化能的大小与反应热无关;加入催化剂,活化能减小,反应反应热不变;
(2)单质硫的燃烧热为296KJ•mol-1,所以热化学方程式为:S(s)+O2(g)═SO2(g)△H=-296kJ/mol,利用盖斯定理解答该题.
解答 解:(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,催化剂降低反应的活化能加快反应的速率,但不能改变反应热,
故答案为:反应物总能量; 生成物总能量;无;降低;催化剂能降低反应的活化能;
(2)因单质硫的燃烧热为296kJ•mol-1,则S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,
而 1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,则SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
由盖斯定律可得:S(s)+$\frac{3}{2}$O2(g)=SO3(g)△H=-296kJ•mol-1+(-99kJ•mol-1)=-395kJ•mol-1,
故答案为:S(s)+$\frac{3}{2}$O2(g)═SO3(g)△H=-395kJ•mol-1.
点评 本题综合考查反应热与焓变,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意催化剂对反应的影响以及反应热计算的应用,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.用中和滴定法测定某烧碱样品的纯度.有以下步骤:
(1)配制待测液:用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻棒外,还需要的玻璃仪器有1000mL容量瓶
(2)滴定:①盛装0.1000mol/L的盐酸标准液应该使用酸式滴定管.
②滴定时双眼应注意观察锥形瓶内溶液颜色的变化.
(3)有关数据记录如下:
计算纯度:烧碱样品的纯度是80.4%; (取两次实验所耗盐酸的平均值进行计算)
(4)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,会使测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,会使测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,会使测定结果偏低;
④装标准液之前,没有用标准液润洗滴定管,会使测定结果偏高.
(1)配制待测液:用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻棒外,还需要的玻璃仪器有1000mL容量瓶
(2)滴定:①盛装0.1000mol/L的盐酸标准液应该使用酸式滴定管.
②滴定时双眼应注意观察锥形瓶内溶液颜色的变化.
(3)有关数据记录如下:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
(4)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,会使测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,会使测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,会使测定结果偏低;
④装标准液之前,没有用标准液润洗滴定管,会使测定结果偏高.
16.下列叙述正确的是( )
| A. | 化学反应必然伴随着能量的变化 | |
| B. | 能量转化的途径不同时,体系包含的总能量不同 | |
| C. | 放热反应指生成物的总能量高于反应物的总能量 | |
| D. | 吸热反应不加热就不会发生 |
20.用氯气消毒的自来水配制下列溶液时,会使配制的溶液变质的是( )
①NaOH②AgNO3③Na2CO3④FeCl2.
①NaOH②AgNO3③Na2CO3④FeCl2.
| A. | 只有②④ | B. | 只有④ | C. | 只有② | D. | 全部 |
1.下列说法中不正确的是( )
| A. | SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 硅胶可做袋装食品的干燥剂 | |
| D. | 晶体硅可用于制作半导体材料与其熔点高硬度大无关 |
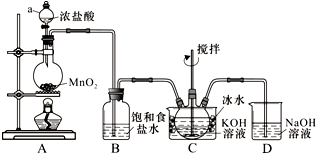
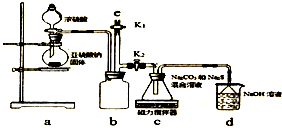 天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染.
天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染.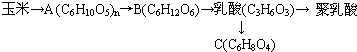
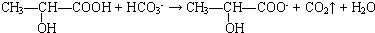
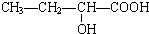 、
、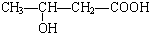 、
、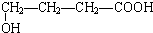
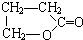 .
.