题目内容
1.(Ⅰ)某温度下,NaCl溶液中的c(H+)=2.0×10-7 mol/L,则此时在溶液中:(1)由水电离产生的c(OH-)=2.0×10-7mol/L;
(2)若温度不变,滴入稀硫酸使c(H+)=5.0×10-6 mol/L,则c(OH-)=8.0×10-7mol/L.
(Ⅱ)(3)某温度下水的离子积为KW=1×10-13,则该温度(填“大于”、“等于”或“小于”)大于25℃.
若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过填写以下不同情况时两种溶液的体积比:
(4)若所得混合液为中性,则a:b=10:1;
(5)若所得混合液的pH=2,则a:b=9:2;
(6)某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,若测定结果偏高,其原因可能是ABCD.
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液.
分析 (Ⅰ)(1)氯化钠溶液中水电离产生的氢离子等于水电离产生的氢氧根离子;
(2)Kw只与温度有关,温度相同K相同,依据Kw=[H+][OH-]计算解答;
(Ⅱ)(3)常温下水的离子积为KW=1×10-14,水的电离为吸热反应,升高温度催进水的电离,Kw增大;
若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH-)=$\frac{10{\;}^{-13}}{10{\;}^{-11}}$mol/L=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,
(4)溶液呈中性,说明酸和碱恰好完全反应,即n(H+)=n(OH-),据此计算两者的体积之比;
(5)若所得混合液的pH=2,根据c(H+)=$\frac{c(酸)V(酸)-c(碱)V(碱)}{V(酸)+V(碱)}$计算酸碱的体积比;
(6)根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析不当操作对V(标准)×的影响,以此判断浓度的误差;
解答 解:(1)氯化钠溶液中水电离产生的氢离子等于水电离产生的氢氧根离子,某温度下,NaCl溶液中的c(H+)=2.0×10-7 mol/L,所以溶液中由水电离产生的c(OH-)=2.0×10-7 mol/L;
故答案为:2.0×10-7 mol/L;
(2)该温度下Kw=2.0×10-7 mol/L×=2.0×10-7mol/L=4×10-14(mol/L)2,若温度不变,滴入稀硫酸使c(H+)=5.0×10-6 mol/L,则c(OH-)=$\frac{Kw}{[OH{\;}^{-}]}$=$\frac{4×10{\;}^{-14}}{5.0×10{\;}^{-6}}$=8.0×10-7 mol/L;
故答案为:8.0×10-7 mol/L;
(3)常温下水的离子积为KW=1×10-14,水的电离为吸热反应,升高温度催进水的电离,Kw增大,某温度下水的离子积为KW=1×10-13,则该温度大于25℃;
故答案为:大于;
若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH-)=$\frac{1{0}^{-13}}{10{\;}^{-11}}$mol/L=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,则
(4)若所得混合液为中性,则有0.01a=0.1b,a:b=10:1,
故答案为:10:1;
(5)若所得混合液的pH=2,则有$\frac{0.1b-0.01a}{a+b}$=0.01,解得:a:b=9:2,
故答案为:9:2;
(6)A.配制标准溶液的固体NaOH中混有KOH杂质,导致配制的标准液含有氢氧根离子浓度偏低,消耗标准液体积偏高,溶液浓度偏高,故A选;
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确,导致消耗的标准液体积偏高,溶液浓度偏高,故B选;
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗,待测液中氢离子浓度增大,消耗的标准液体积偏大,溶液浓度偏高,故C选;
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液,导致计算一滴标准液,消耗标准液体积偏大,溶液浓度偏高,故D选;
故选:ABCD.
点评 本题考查水的电离及溶液酸碱性判断、酸碱混合的定性判断,明确水的离子积常数应用及影响因素,会根据溶液的酸碱性及电荷守恒判断离子浓度大小,注意(2)(3)中水的离子积常数是4×10-14而不是1×10-14,否则会导致错误,注意中和滴定原理及误差分析的方法和技巧.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案| A. | Na2CO3是钠盐 | B. | Na2CO3是含氧酸盐 | ||
| C. | Na2CO3是碳酸盐 | D. | Na2CO3是碱 |
| A. | 用量筒量取KMnO4溶液12.00mL | |
| B. | 测定中和热时将NaOH溶液迅速一次性倒入盛有盐酸的小烧杯中,盖好盖板 | |
| C. | 常温下,测得0.01mol/LNaHCO3溶液的pH值=12 | |
| D. | 加热蒸发FeCl3溶液,获得FeCl3固体 |
| A. | 用碱式滴定管准确量取20.00 mL的高锰酸钾溶液 | |
| B. | 用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高 | |
| C. | 用NaOH滴定盐酸时,只能用酚酞作指示剂 | |
| D. | 用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂 |
以下是标定KMnO4溶液的实验步骤:
步骤一:先配制浓度约为0.10mol•L-1的高锰酸钾溶液500mL.
步骤二:取0.02mol•L-1 的Na2C2O420.00mL放入锥形瓶中,并加稀硫酸酸化,用步骤一所配高锰酸钾溶液进行滴定.三次平行实验的数据记录在表中:
| 平行实验编号 | Na2C2O4溶液 (mL) | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
| 1 | 20.00 | 0.00 | 21.18 |
| 2 | 20.00 | 1.02 | 21.00 |
| 3 | 20.00 | 1.18 | 21.20 |
(1)步骤一中要用到的主要玻璃仪器是除烧杯、玻璃棒外还需.
(2)步骤二中滴定操作选用滴定管(填“酸式”或“碱式”)滴定终点的判断方法:
(3)下来滴定操作会导致测量结果偏高的是
A、滴定管滴定前有气泡,滴定后气泡消失 B、锥形瓶洗涤后没有干燥
C、滴定终点时,读数时俯视 D、滴定时锥形瓶中有液体溅出
E、一滴高锰酸钾溶液附在锥形瓶壁上未冲下
(4)从实验所得数据计算,KMnO4溶液的浓度为mol•L-1.
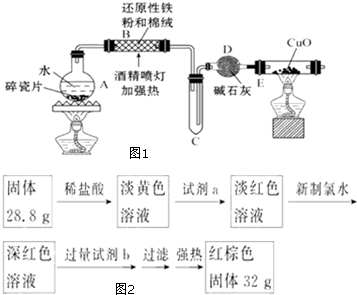 某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题: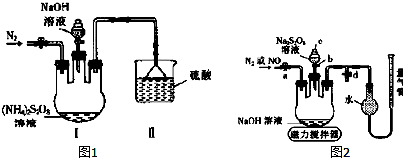
 2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1反应过程的能量变化如图所示.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1反应过程的能量变化如图所示.请回答下列问题: