题目内容
16.下列叙述正确的是( )| A. | 化学反应必然伴随着能量的变化 | |
| B. | 能量转化的途径不同时,体系包含的总能量不同 | |
| C. | 放热反应指生成物的总能量高于反应物的总能量 | |
| D. | 吸热反应不加热就不会发生 |
分析 化学反应伴随着能量变化,反应的吸放热取决于反应物与生成物的总能量,且反应的吸放热与反应条件无关,以此解答.
解答 解:A.物质发生化学反应都伴随着能量变化,与化学键的断裂和形成有关,断键吸收能量,形成化学键放出能量,故A正确;
B.反应热与反应物、生成物的总能量有关,与反应的途径无关,故B错误;
C.反应物的总能量大于生成物的总能量,为放热反应,故C错误;
D.氢氧化钡和氯化铵的反应为吸热反应,无需加热,故D错误.
故选A.
点评 本题考查化学反应伴随着能量的变化,为高频考点,侧重于学生的双基的考查,题目涉及化学反应中质量守恒、能量守恒,难度不大.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
1.羰基硫(COS)可用作粮食熏蒸剂,可由CO 与H2S 在一定条件下反应制得.在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g)?COS(g)+H2(g),数据如表所示:
下列说法正确的是( )
| 实验 | 温度/℃ | 起始时 | 平衡时 | |||
| n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
| 1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
| 2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
| 3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
| A. | 上述反应是吸热反应 | |
| B. | 实验1 达平衡时,CO 的转化率为70% | |
| C. | 实验2 达平衡时,a<7.0 | |
| D. | 实验3 达平衡后,再充入1.0molH2,K 值增大,平衡逆向移动 |
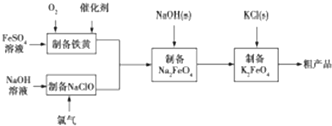
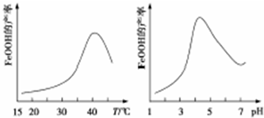
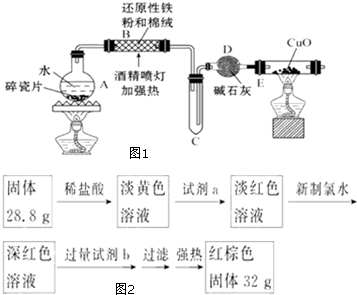 某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题: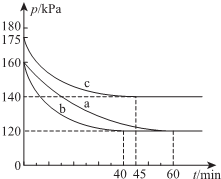 一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
一定条件下,通过下列反应可实现燃煤烟气中硫的回收: 2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1反应过程的能量变化如图所示.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1反应过程的能量变化如图所示.请回答下列问题: