题目内容
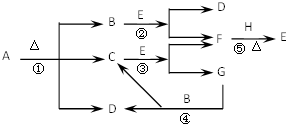 已知化合物A、D、E、G进行焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多.A~H各物质的变化关系如图所示.
已知化合物A、D、E、G进行焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多.A~H各物质的变化关系如图所示.(1)写出各步反应的化学方程式
反应①
反应②
反应④
反应⑤
(2)请将反应③用双线桥法标明该反应中电子的转移及数目;在表格中填出反应式中的氧化剂、还原剂,氧化产物、还原产物;并将其改写成离子方程式.
双线桥法表示电子转移情况:
| 氧化剂: | Na2O2 | 还原剂: | Na2O2 |
| 氧化产物: | O2 | 还原产物: | H2O |
考点:无机物的推断
专题:推断题
分析:化合物A、D、E、G焰色反应时,火焰均呈黄色,证明含有钠元素;其中A可用作家庭食品添加剂,也可用以治疗胃酸过多,则A为NaHCO3;A分解生成二氧化碳、水、碳酸钠,D焰色反应为黄色,则D为Na2CO3,E含钠元素,能与水、二氧化碳反应生成F,可推知E为Na2O2,F为O2,由转化关系可知B为CO2,C为H2O,G为NaOH,H为Na,据此解答.
解答:
解:化合物A、D、E、G焰色反应时,火焰均呈黄色,证明含有钠元素;其中A可用作家庭食品添加剂,也可用以治疗胃酸过多,则A为NaHCO3;A分解生成二氧化碳、水、碳酸钠,D焰色反应为黄色,则D为Na2CO3,E含钠元素,能与水、二氧化碳反应生成F,可推知E为Na2O2,F为O2,由转化关系可知B为CO2,C为H2O,G为NaOH,H为Na,
(1)①反应为碳酸氢钠受热分解,化学方程式为:2NaHCO3
Na2CO3+CO2↑+H2O;
反应②过氧化钠和二氧化碳的反应,化学方程式为:2Na2O2+2CO2=2Na2CO3+O2;
反应④是二氧化碳和氢氧化钠反应,化学方程式为:2NaOH+CO2=Na2CO3+H2O;
反应⑤是钠和氧气的反应,化学方程式为:2Na+O2
Na2O2;
故答案为:2NaHCO3
Na2CO3+CO2↑+H2O;2Na2O2+2CO2=2Na2CO3+O2;2NaOH+CO2=Na2CO3+H2O;2Na+O2
Na2O2;
(2)反应③是过氧化钠和水的反应:2Na2O2+2H2O=4NaOH+O2↑,实质是过氧化钠与水反应得到过氧化氢、氢氧化钠,过氧化氢在分解生成水与氧气,反应为:2Na2O2+4H2O=4NaOH+2H2O+O2↑,氧化剂是:Na2O2,还原剂:Na2O2,氧化产物:O2,还原产物为:H2O,标出电子转移数目与方向为: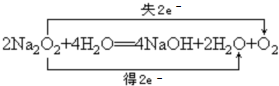 ,反应离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
,反应离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为: ;
;
;2Na2O2+2H2O=4Na++4OH-+O2↑.
(1)①反应为碳酸氢钠受热分解,化学方程式为:2NaHCO3
| ||
反应②过氧化钠和二氧化碳的反应,化学方程式为:2Na2O2+2CO2=2Na2CO3+O2;
反应④是二氧化碳和氢氧化钠反应,化学方程式为:2NaOH+CO2=Na2CO3+H2O;
反应⑤是钠和氧气的反应,化学方程式为:2Na+O2
| ||
故答案为:2NaHCO3
| ||
| ||
(2)反应③是过氧化钠和水的反应:2Na2O2+2H2O=4NaOH+O2↑,实质是过氧化钠与水反应得到过氧化氢、氢氧化钠,过氧化氢在分解生成水与氧气,反应为:2Na2O2+4H2O=4NaOH+2H2O+O2↑,氧化剂是:Na2O2,还原剂:Na2O2,氧化产物:O2,还原产物为:H2O,标出电子转移数目与方向为:
 ,反应离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
,反应离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,故答案为:
 ;
; | 氧化剂: | Na2O2 | 还原剂: | Na2O2 |
| 氧化产物: | O2 | 还原产物: | H2O |
点评:本题考查无机物推断,涉及Na元素化合物性质与转化,需要学生熟练掌握元素化合物性质,(2)中电子转移表示为易错点、难点,明确反应进行的本质是关键.

练习册系列答案
相关题目
向100mL0.1mol/L的氢氧化钠溶液中缓慢通入一定量的CO2气体,下列有关反应后的溶液说法错误的是( )
| A、该溶液中一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B、该溶液中可能存在:c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
| C、向该溶液中滴入少量稀盐酸,一定会产生气泡 |
| D、向该溶液中滴入少量Ca(OH)2溶液,一定会有白色沉淀产生 |
 (1)如图所示装置,回答下列问题盐桥中阴离子移向
(1)如图所示装置,回答下列问题盐桥中阴离子移向
 某化学兴趣小组的同学用以下装置研究电化学的问题.甲装置是由铜、锌和稀硫酸组成的原电池,其中正极材料是
某化学兴趣小组的同学用以下装置研究电化学的问题.甲装置是由铜、锌和稀硫酸组成的原电池,其中正极材料是 I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,回答下列问题:
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,回答下列问题: