题目内容
6.下列离子方程式的书写正确的是( )| A. | 实验室用大理石和稀盐酸制取CO2:CO32-+2H+═CO2↑+H2O | |
| B. | Al(OH)3加入NaOH溶液:Al(OH)3+OH-═AlO2-+2H2O | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 向偏铝酸钠溶液通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
分析 A.大理石的主要成分为碳酸钙,碳酸钙为难溶物,不能拆开;
B.氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
C.氢氧化钠过量,反应生成偏铝酸根离子;
D.二氧化碳过量,反应生成碳酸氢根离子.
解答 解:A.碳酸钙小于保留化学式,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.Al(OH)3加入NaOH溶液,反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故B正确;
C.向AlCl3溶液中加入过量的NaOH溶液,反应生成偏铝酸钠和水,正确的离子方程式为:Al3++4OH-═AlO2-+2H2O,故C错误;
D.向偏铝酸钠溶液通入过量的CO2,反应生成氢氧化铝沉淀和碳酸氢钠,正确的离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
16.已知C-C键可以绕键轴自由旋转,结构简式为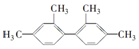 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )
 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至少有16个碳原子处于同一平面上 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 该烃不属苯的同系物 |
14.25℃时,1mol•L-1的NH4Cl、CH3COONH4、NH4HSO4三种溶液中,测得c(NH4+)分别为a、b、c(单位为mol•L-1),下列判断正确的是( )
| A. | a=b=c | B. | a>b>c | C. | a>c>b | D. | c>a>b |
1. 工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2═CH2(g)+H2O(g)?CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等.如图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是( )
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2═CH2(g)+H2O(g)?CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等.如图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是( )
 工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2═CH2(g)+H2O(g)?CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等.如图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是( )
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2═CH2(g)+H2O(g)?CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等.如图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是( )| A. | 合成乙醇的反应一定为吸热反应 | |
| B. | 目前工业上采用250~300℃,主要是因为在此温度下乙烯的转化率最大 | |
| C. | 目前工业上采用加压条件(7 MPa左右),目的是提高乙醇的产率和加快反应速率 | |
| D. | 只要给予该反应足够的压强,就可以实现转化率100% |
11.草酸是二元中强酸,草酸氢钠溶液显酸性,常温下,向10ml 0.1 mol•L-1NaHC2O4溶液中滴加 0.1mol•L-1NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
| A. | V(NaOH)=0时,c(H+)=1×10-2mol•L-1 | |
| B. | V(NaOH)=10mL时,c(H+)=1×10-7mol•L-1 | |
| C. | V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-) | |
| D. | V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
18.下列叙述正确的是( )
| A. | 食盐水克导电,所以食盐水是电解质 | |
| B. | NH3的水溶液能够导电,所以NH3电解质 | |
| C. | 蔗糖溶于水不导电,所以蔗糖是非电解质 | |
| D. | BaSO4投入水中,导电性极弱,所以BaSO4是弱电解质 |
15.只用一种试剂就可以鉴别乙酸溶液、葡萄糖溶液、乙醇,这种试剂是( )
| A. | NaOH溶液 | B. | Na2CO3溶液 | ||
| C. | 石蕊试液 | D. | 新制的Cu(OH)2悬浊液 |
16. 下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是( )
下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是( )
 下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是( )
下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是( )| X | Y | Z | |
| A | SO2 | CO | CaCl2 |
| B | NH3 | CO2 | Al2(SO4)3 |
| C | NO2 | SO2 | BaCl2 |
| D | Cl2 | O2 | Na2S |
| A. | A | B. | B | C. | C | D. | D |