题目内容
1. 工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2═CH2(g)+H2O(g)?CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等.如图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是( )
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2═CH2(g)+H2O(g)?CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等.如图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是( )| A. | 合成乙醇的反应一定为吸热反应 | |
| B. | 目前工业上采用250~300℃,主要是因为在此温度下乙烯的转化率最大 | |
| C. | 目前工业上采用加压条件(7 MPa左右),目的是提高乙醇的产率和加快反应速率 | |
| D. | 只要给予该反应足够的压强,就可以实现转化率100% |
分析 A、由图可知,压强一定,温度越高乙烯的转化率越低,说明升高温度平衡向逆反应移动,据此判断;
B、由图可知,压强一定,温度越高乙烯的转化率越低,低温有利于乙烯的转化;
C、由图可知,温度一定,压强越高乙烯的转化率越高,反应速率加快,缩短到达平衡的时间;
D、可逆反应不可能100%的转化.
解答 解:A、由图可知,压强一定,温度越高乙烯的转化率越低,说明升高温度平衡向逆反应移动,故该反应正反应是放热反应,故A正确;
B、由图可知,压强一定,温度越高乙烯的转化率越低,低温有利于乙烯的转化,采用250~300℃不是考虑乙烯的转化率,可能是考虑催化剂的活性、反应速率等,故B错误;
C、由图可知,温度一定,压强越高乙烯的转化率越高,反应速率加快,缩短到达平衡的时间,故采用加压条件(7MPa左右),目的是提高乙醇的产率和加快反应速率,故C正确;
D、可逆反应不可能100%的转化,所以不论怎么改变条件,转化率不可能达100%,故D错误;
故选C.
点评 本题考查化学平衡图象、影响平衡的元素、对工业生成条件控制的分析等,难度中等,D选项注意根可逆反应的特征进行解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列有关说法正确的是( )
| A. | 硫酸铜、二氧化硫都是电解质 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| D. | SiO2既能和氢氧化钠溶液反应也能和氨氟酸反应,所以是两性氧化物 |
12.氮元素有着多变价态和种类繁多的化合物,因在生产、生活中发挥着重要的作用.完成下列问题:
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表:
①比较K1、K2的大小:K1>K2(填“>”、“=”或“<”).
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是acd(填序号).
a.2v(H2)正=3v(NH3)逆 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率减小(填“增大”、“减小”或“不变”);平衡常数不变.(填“增大”、“减小”或“不变”)
( 2 )肼是氮元素的另一种氢化物,分子式为N2H4.
①298K时,1.00g N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15kJ的热量.写该反应的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)△H=-1225.6kJ/mol.
②肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式N2H4-4e-=N2+4H+.
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表:
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是acd(填序号).
a.2v(H2)正=3v(NH3)逆 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率减小(填“增大”、“减小”或“不变”);平衡常数不变.(填“增大”、“减小”或“不变”)
( 2 )肼是氮元素的另一种氢化物,分子式为N2H4.
①298K时,1.00g N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15kJ的热量.写该反应的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)△H=-1225.6kJ/mol.
②肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式N2H4-4e-=N2+4H+.
16.能正确表示下列反应的离子方程式的是( )
| A. | 将Cl2通入氯化亚铁溶液:Fe2++Cl2═Fe3++2Cl- | |
| B. | 金属钠加入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ |
6.下列离子方程式的书写正确的是( )
| A. | 实验室用大理石和稀盐酸制取CO2:CO32-+2H+═CO2↑+H2O | |
| B. | Al(OH)3加入NaOH溶液:Al(OH)3+OH-═AlO2-+2H2O | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 向偏铝酸钠溶液通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
10.天然皮革是( )
| A. | 纤维素制品 | B. | 脂肪类物质 | ||
| C. | 橡胶制品 | D. | 凝固和变性的蛋白质 |
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使石蕊变红色的溶液:Fe2+、K+、SO42-、NO3- | |
| B. | 使酚酞变红色的溶液:Na+、Mg2+、Cl-、Al3+ | |
| C. | 0.1mol•L-1Na2SO3溶液:K+、SO42-、ClO- | |
| D. | 0.1mol•L-1NaAlO2溶液:Na+、Cl-、OH-、SO42- |
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业,表格中给出了一些物质的物理常数,请回答下列问题
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业,表格中给出了一些物质的物理常数,请回答下列问题
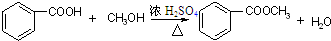 .
.