题目内容
14.25℃时,1mol•L-1的NH4Cl、CH3COONH4、NH4HSO4三种溶液中,测得c(NH4+)分别为a、b、c(单位为mol•L-1),下列判断正确的是( )| A. | a=b=c | B. | a>b>c | C. | a>c>b | D. | c>a>b |
分析 相同温度、相同浓度的这三种盐溶液,氢离子抑制铵根离子水解、醋酸根离子促进铵根离子水解,铵根离子水解程度越大,则溶液中铵根离子浓度越小.据此分析.
解答 解:相同温度、相同浓度的这三种盐溶液,氢离子抑制铵根离子水解、醋酸根离子促进铵根离子水解,铵根离子水解程度越大,则溶液中铵根离子浓度越小,所以溶液中铵根离子浓度大小顺序是c>a>b,故选D.
点评 本题考查了盐类水解,明确影响盐类水解的因素是解本题关键,根据铵根离子水解程度大小解答即可,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.根据下列操作及现象,所得结论正确的是( )
| 选项 | 操作及现象 | 结论 |
| A | 将0.1mol•L-1氨水稀释成0.01mol•L-1,测得pH由11.1变成10.6 | 稀释后NH3•H2O的电离程度减小 |
| B | 将铜片与锌片用导线连接后,插入稀硫酸中,铜片上有气泡产生 | 在锌的作用下,铜与硫酸反应产生氢气 |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 将固体CaSO4加入Na2CO3饱和溶液中,一段时间后,检验固体成分为CaCO3 | 同温下溶解度:CaSO4<CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
19.只用一种试剂区别MgSO4、FeSO4、Al2(SO4)3、(NH4)2SO4四种溶液,这种试剂是( )
| A. | BaCl2 | B. | H2SO4 | C. | AgNO3 | D. | NaOH |
6.下列离子方程式的书写正确的是( )
| A. | 实验室用大理石和稀盐酸制取CO2:CO32-+2H+═CO2↑+H2O | |
| B. | Al(OH)3加入NaOH溶液:Al(OH)3+OH-═AlO2-+2H2O | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 向偏铝酸钠溶液通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
3.NA为阿伏加德罗常数的值,下列说法错误的是( )
| A. | 10.0 g CaCO3与足量稀盐酸反应,消耗H+的数目为0.2 NA | |
| B. | 0.1 mol Ar所含的原子数为0.1NA | |
| C. | 200 mL 0.1 mol/L的Na2SO4中含Na+数目为0.04NA | |
| D. | 25℃、101 kPa时,Zn与稀硫酸反应生成2.24 L H2,转移的电子总数为0.2NA |
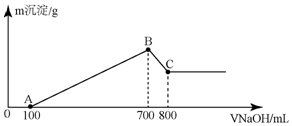 将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示,请填写下列空白:
将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示,请填写下列空白: