题目内容
8.某化学反应中,设反应物的总能量为E1,生成物的总能量为E2.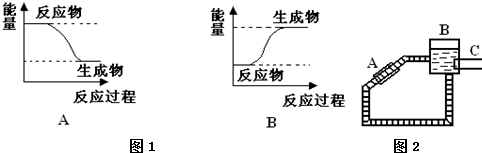
(1)若E1>E2,则该反应为放热(填“放热”或“吸热”)反应.该反应可用图1A(填“A”或“B”)表示.
(2)太阳能的开发和利用是21世纪的一个重要课题.
①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节.已知下列数据:
| 盐 | 熔点/℃ | 熔化吸热/KJ•mol-1 | 参考价格/元•kg-1 |
| CaCl2•6H2O | 29.0 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 36.1 | 100.1 | 1600~2000 |
| Na2S2O3•5H2O | 48.5 | 49.7 | 1400~1800 |
A.CaCl2•6H2OB.Na2SO4•10H2O
C.Na2HPO4•12H2OD.Na2S2O3•5H2O
②图2是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器.
根据对水的密度的认识,你估计在阳光照射下水将沿顺(填“顺”或“逆”)时针方向流动.
分析 (1)根据反应物的总能量为E1和生成物的总能量为E2的相对大小判断;
(2)①根据表中信息判断哪种物质的熔点在40℃以下,并且单位质量的物质熔化时吸收的热量多等方面进行分析、考虑,从而得出正确的结论.
②根据冷水与热水密度不同;
解答 解:(1)反应物的总能量为E1,生成物的总能量为E2,则E1>E2,则该反应为放热反应,可用图1A表示,故答案为:放热;A;
(2)①选择的物质应该具有的特点是:在白天在太阳照射下,某种盐熔化,熔化时单位质量的物质吸收热量应该最多,同时价格不能太高,则Na2HPO4•12H2O的性价比最高,所以选Na2SO4•10H2O,故选:B.
②因集热器中的水被太阳光晒热后密度变小,受到浮力作用沿管向右上方运动形成顺时针方向流动的水流,故答案为:顺.
点评 本题主要考查了反应中的能量变化的原因,难度不大,需要强调的是能量高的物质性质不稳定,能量低的物质性质稳定.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
相关题目
18.95℃时某溶液的pH=6,对该溶液的判断正确的是( )
| A. | 呈酸性 | B. | c(H+)=1×10-6mol/L | ||
| C. | c(OH-)=1×10-6mol/L | D. | 无法判断 |
19.下列关于物质的分类、性质、用途说法全部正确的是( )
| A. | 水玻璃-混合物氨水-弱碱 | |
| B. | 油脂-天然高分子化合物 有机玻璃-合成高分子化合物 | |
| C. | 二氧化硅-半导体材料硅单质-光纤材料 | |
| D. | 高锰酸钾溶液-氧化性碳酸钠溶液-碱性 |
16.0.1mol化合物甲在足量的氧气中完全燃烧后生成4.48LCO2(标况下测量),推测甲是( )
| A. | CH4 | B. | C2H4 | C. | C3H8 | D. | C6H6 |
3.各式各样电池的发展是化学对人类的一项重大贡献.下列有关电池的叙述正确的是( )
| A. | 手机上用的锂离子电池属于一次电池 | |
| B. | 人们回收废旧电池主要是为了防止重金属对水土的污染 | |
| C. | 氢氧燃料电池的能量转化率可达100% | |
| D. | 太阳能电池的主要材料为二氧化硅 |
13. 如图,B为常见金属或非金属单质,有下列转化关系.若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )
如图,B为常见金属或非金属单质,有下列转化关系.若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )
 如图,B为常见金属或非金属单质,有下列转化关系.若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )
如图,B为常见金属或非金属单质,有下列转化关系.若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )| A. | CuCl2 | B. | AlCl3 | C. | H2O2 | D. | NaCl |
20. 实验室制备1,2一二溴乙烷的反应原理如下:
实验室制备1,2一二溴乙烷的反应原理如下:
CH3CH2OH$\frac{{H}_{2}S{O}_{4}(浓)}{170℃}$CH2=CH2 CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2一二溴乙烷的装置如图所示:
有关数据列表如下:
请按要求回答下列问题:
回答下列问题:
(1)装置A中仪器a和b的名称分别为恒压分液漏斗、三颈烧瓶;
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)判断该制备反应已经结束的最简单方法是观察D中颜色是否完全褪去;
(4)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.亚硫酸氢钠 c.碘化钠溶液 d.乙醇
(5)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2一二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
 实验室制备1,2一二溴乙烷的反应原理如下:
实验室制备1,2一二溴乙烷的反应原理如下:CH3CH2OH$\frac{{H}_{2}S{O}_{4}(浓)}{170℃}$CH2=CH2 CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2一二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1.2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置A中仪器a和b的名称分别为恒压分液漏斗、三颈烧瓶;
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)判断该制备反应已经结束的最简单方法是观察D中颜色是否完全褪去;
(4)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.亚硫酸氢钠 c.碘化钠溶液 d.乙醇
(5)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2一二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+1H2O+(1)KOH
+2MnO2↓+1H2O+(1)KOH 与C按1:1生成高分子化合物的反应方程式为
与C按1:1生成高分子化合物的反应方程式为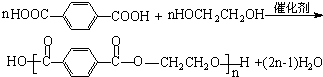 .
.