题目内容
17.下列排列顺序正确的是( )①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③电负性:Cl>P>S
④结合质子能力:OH->CH3COO->Cl-.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
分析 ①非金属性越强,对应氢化物越稳定;
②电子层越多,原子半径越大,同周期从左向右原子半径减小;
③非金属性越强,电负性越大;
④对应酸的酸性越强,阴离子结合质子的能力越小.
解答 解:①非金属性越强,对应氢化物越稳定,则热稳定性:HF>H2O>H2S,故错误;
②电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:Na>Mg>O,故正确;
③非金属性越强,电负性越大,则电负性:Cl>S>P,故错误;
④对应酸的酸性越强,阴离子结合质子的能力越小,则结合质子能力:OH->CH3COO->Cl-,故正确;
故选B.
点评 本题考查元素周期律和周期表,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列离子方程式书写正确的是( )
| A. | 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O | |
| D. | 硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+=Fe3++2H2O |
8.某化学反应中,设反应物的总能量为E1,生成物的总能量为E2.

(1)若E1>E2,则该反应为放热(填“放热”或“吸热”)反应.该反应可用图1A(填“A”或“B”)表示.
(2)太阳能的开发和利用是21世纪的一个重要课题.
①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节.已知下列数据:
其中最适宜作储能介质的一种盐是B(填字母).
A.CaCl2•6H2OB.Na2SO4•10H2O
C.Na2HPO4•12H2OD.Na2S2O3•5H2O
②图2是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器.
根据对水的密度的认识,你估计在阳光照射下水将沿顺(填“顺”或“逆”)时针方向流动.

(1)若E1>E2,则该反应为放热(填“放热”或“吸热”)反应.该反应可用图1A(填“A”或“B”)表示.
(2)太阳能的开发和利用是21世纪的一个重要课题.
①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节.已知下列数据:
| 盐 | 熔点/℃ | 熔化吸热/KJ•mol-1 | 参考价格/元•kg-1 |
| CaCl2•6H2O | 29.0 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 36.1 | 100.1 | 1600~2000 |
| Na2S2O3•5H2O | 48.5 | 49.7 | 1400~1800 |
A.CaCl2•6H2OB.Na2SO4•10H2O
C.Na2HPO4•12H2OD.Na2S2O3•5H2O
②图2是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器.
根据对水的密度的认识,你估计在阳光照射下水将沿顺(填“顺”或“逆”)时针方向流动.
5.少量铁片与 l00mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加 H2O
②加 KNO3溶液
③滴入几滴浓盐酸
④加入少量铁粉
⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发)
⑧改用 10mL 0.1mol/L 盐酸.
①加 H2O
②加 KNO3溶液
③滴入几滴浓盐酸
④加入少量铁粉
⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发)
⑧改用 10mL 0.1mol/L 盐酸.
| A. | ①⑥⑦ | B. | ③⑤⑧ | C. | ③⑦⑧ | D. | ③⑥⑦⑧ |
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O含有分子数为NA | |
| B. | 分子总数为NA的N2、CO混合气体体积约为22.4 L,质量为28 g | |
| C. | 常温常压下,1.6 g CH4含原子数为0.5NA | |
| D. | 4 g金属钙变成钙离子时失去的电子数目为0.1 NA |
9.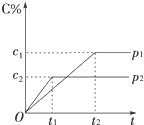 在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是( )
在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是( )
 在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是( )
在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是( )| A. | p1>p2 | B. | p1=p2 | C. | m+n>p+q | D. | m+n<p+q |
6.下列关于卤素的叙述正确的是( )
①卤素的钾盐中,最易被氧化的是氟化钾
②溴水溶有少量氯气,可以加入溴化钠在用汽油萃取的方法提纯
③溴化银具有感光性,碘化银不具有感光性
④氟气跟氯化钠水溶液反应,一定有氟化氢和氧气生成
⑤氯气跟水反应时,水既不是氧化剂也不是还原剂.
①卤素的钾盐中,最易被氧化的是氟化钾
②溴水溶有少量氯气,可以加入溴化钠在用汽油萃取的方法提纯
③溴化银具有感光性,碘化银不具有感光性
④氟气跟氯化钠水溶液反应,一定有氟化氢和氧气生成
⑤氯气跟水反应时,水既不是氧化剂也不是还原剂.
| A. | ①③④ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③ |
13.下表为元素周期表的一部分.
(1)表中元素F的非金属性最强;元素K的金属性最强;元素Br的单质室温下呈液态(填写元素符号);
(2)表中元素 (11)的原子结构示意图是 ;
;
(3)表中元素⑥⑨⑩氢化物的稳定性顺序为HF>HCl>H2S(填写化学式,下同);
(4)表中元素⑨和⑩最高价氧化物对应水化物的酸性:HClO4>H2SO4.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | (11) | (12) | (13) | ||||
(2)表中元素 (11)的原子结构示意图是
 ;
;(3)表中元素⑥⑨⑩氢化物的稳定性顺序为HF>HCl>H2S(填写化学式,下同);
(4)表中元素⑨和⑩最高价氧化物对应水化物的酸性:HClO4>H2SO4.