题目内容
10.下列热化学方程式或说法正确的是( )| A. | 甲烷的燃烧热为890.3 kJmor-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+202 (g)═C02 (g)+2H20(g)△H=-890.3kJ mol-1 | |
| B. | 500 V、30MPa下,将0.5molN2和1.5 molH2置于密闭的容器中充分反应生成 NH3(g),放热19.3kJ,其热化学方程式为 N2(g)+3H2 (g)$?_{500℃、30Mp}^{催化剂}$2NH3(g)△H=-38.6 kJmol-1 | |
| C. | 同温同压下,等物质的量的H2与足量的C12在光照和点燃条件下充分反应,所产生的热量相同 | |
| D. | 已知中和热为57.3 kJ/mol,则稀硫酸与氢氧化钡溶液反应的热化学方程式为 2H+(aq)+SO42-(aq)+Ba2+(aq)+20H-(aq)=BaS04 (s)+2H20(l)△H=-57.3kJ/mol |
分析 A.甲烷燃烧热是1mol甲烷完全反应生成二氧化碳气体与液态水放出的热量;
B.可逆反应中反应物不能完全转化,转化的氮气小于0.5mol,则1mol氮气反应时放出的热量大于38.6kJ;
C.相同条件下,反应物能量相同,生成物能量相同,则产生的热量相同;
D.生成硫酸钡会放出能量,且生成2mol水,放出的热量应大于114.6kJ.
解答 解:A.甲烷燃烧热是1mol甲烷完全反应生成二氧化碳气体与液态水放出的热量,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2 (g)═CO2 (g)+2H2O(l)△H=-890.3kJ mol-1,1mol甲烷完全反应生成气态水时放出的热量小于890.3kJ,故A错误;
B.可逆反应中反应物不能完全转化,转化的氮气小于0.5mol,则1mol氮气反应时放出的热量大于38.6kJ,选项中热化学方程式中△H<-38.6 kJmol-1,故B错误;
C.相同条件下,反应物能量相同,生成物能量相同,则产生的热量相同,故C正确;
D.生成硫酸钡会放出能量,且生成2mol水,放出的热量应大于114.6kJ,选项中△H<-114.6kJ/mol,
故选:C.
点评 本题考查热化学方程式书写、燃烧热、中和热及反应热有关计算等,理解中和热与燃烧热含义,注意可逆反应不完全转化性.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
1.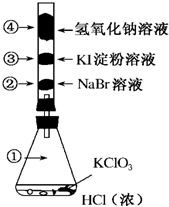 已知常温下氯酸钾与浓盐酸反应放出氯气,现按如图进行氯、溴、碘的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
已知常温下氯酸钾与浓盐酸反应放出氯气,现按如图进行氯、溴、碘的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
 已知常温下氯酸钾与浓盐酸反应放出氯气,现按如图进行氯、溴、碘的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
已知常温下氯酸钾与浓盐酸反应放出氯气,现按如图进行氯、溴、碘的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )| A. | ①黄绿色 ②橙色 ③蓝色 ④白色 | B. | ①无色 ②橙色 ③紫色 ④白色 | ||
| C. | ①黄绿色 ②橙色 ③蓝色 ④无色 | D. | ①黄绿色 ②无色 ③紫色 ④白色 |
18. 工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )
工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )
 工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )
工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )| A. | 反应的化学方程式:CO+2H2?CH3OH | |
| B. | 反应进行至3分钟时,正、逆反应速率相等 | |
| C. | 反应至10分钟,?(CO)=0.075 mol/L•min | |
| D. | 增大压强,平衡正向移动,K增大 |
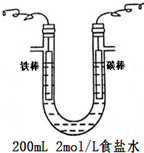
5.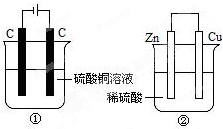 如图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole-,若不考虑溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole-,若不考虑溶液体积的变化,下列叙述正确的是( )
 如图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole-,若不考虑溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole-,若不考虑溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积①=② | |
| B. | 溶液的pH变化:①减小②增大 | |
| C. | 电极上析出固体质量①<② | |
| D. | 电极反应式:①中阳极:Cu2++2e-═Cu②中负极Zn-2e-═Zn2+ |
20.下列离子方程式书写正确的是( )
| A. | Na投入到足量的盐酸中:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 向碳酸氢钠溶液中加入过量氢氧化钙溶液:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 三氯化铁溶液中加入铜粉:Fe3++Cu═Fe2++Cu2+ | |
| D. | 将氯气通入冷的氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
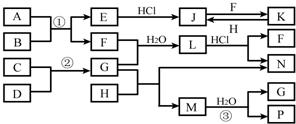 如图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去).
如图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去). ;
; 熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池,已知其电池反应相当于CO的燃烧,且负极反应式为2CO+2CO32--4e-=4CO2
熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池,已知其电池反应相当于CO的燃烧,且负极反应式为2CO+2CO32--4e-=4CO2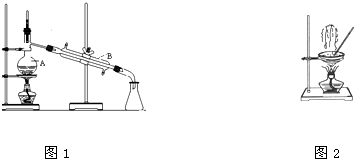 (1)如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: