题目内容
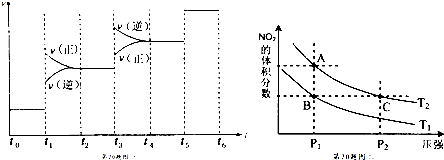
18. 工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )
工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )| A. | 反应的化学方程式:CO+2H2?CH3OH | |
| B. | 反应进行至3分钟时,正、逆反应速率相等 | |
| C. | 反应至10分钟,?(CO)=0.075 mol/L•min | |
| D. | 增大压强,平衡正向移动,K增大 |
分析 A.由图可知,反应至10分钟达到平衡状态,△c(CO)=1mol/L-0.25mol/L,△c(CH3OH)=0.75mol/L-0=0.75mol/L,△c(CO):△c(CH3OH)=1:1,配平氢气即可;
B.反应进行至3分钟时,并没有达到化学平衡状态;
C.反应至10分钟时,△c(CO)=1mol/L-0.25mol/L,带入v=$\frac{△c}{△t}$计算;
D.增大压强,平衡向气体体积减小的方向移动,K不变.
解答 解:A.由图可知,反应至10分钟达到平衡状态,△c(CO)=1mol/L-0.25mol/L=0.75mol/L,△c(CH3OH)=0.75mol/L-0=0.75mol/L,△c(CO):△c(CH3OH)=1:1,反应的化学方程式:CO+2H2?CH3OH,故A正确;
B.反应进行至3分钟时,并没有达到化学平衡状态,因此正、逆反应速率不相等,故B错误;
C.反应至10分钟时,△c(CO)=1mol/L-0.25mol/L=0.75mol/L,v(CO)=$\frac{0.75mol/L}{10min}$=0.075 mol/(L•min),故C正确;
D.增大压强,平衡向气体体积减小的方向移动,K只受温度的影响,K不变,故D错误;
故选BD.
点评 本条考查了化学平衡的建立过程,侧重于化学反应速率的计算、平衡状态的判定和平衡移动,难度不大,其中B、D为易错点.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
13.有关FeSO4溶液的说法正确的是( )
| A. | 溶液为浅绿色 | |
| B. | 溶液为棕黄色 | |
| C. | 加入硫氰化钾溶液显红色 | |
| D. | 滴加NaOH溶液,产生白色沉淀,该沉淀放置在空气中不变色 |
3.下列叙述正确的是( )
| A. | 同温同压下,两种气体的体积之比等于摩尔质量之比 | |
| B. | 同温同压下,两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下,两种气体的摩尔质量之比等于密度之比 | |
| D. | 同温同容下,两种气体的质量之比等于压强之比 |
10.下列热化学方程式或说法正确的是( )
| A. | 甲烷的燃烧热为890.3 kJmor-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+202 (g)═C02 (g)+2H20(g)△H=-890.3kJ mol-1 | |
| B. | 500 V、30MPa下,将0.5molN2和1.5 molH2置于密闭的容器中充分反应生成 NH3(g),放热19.3kJ,其热化学方程式为 N2(g)+3H2 (g)$?_{500℃、30Mp}^{催化剂}$2NH3(g)△H=-38.6 kJmol-1 | |
| C. | 同温同压下,等物质的量的H2与足量的C12在光照和点燃条件下充分反应,所产生的热量相同 | |
| D. | 已知中和热为57.3 kJ/mol,则稀硫酸与氢氧化钡溶液反应的热化学方程式为 2H+(aq)+SO42-(aq)+Ba2+(aq)+20H-(aq)=BaS04 (s)+2H20(l)△H=-57.3kJ/mol |
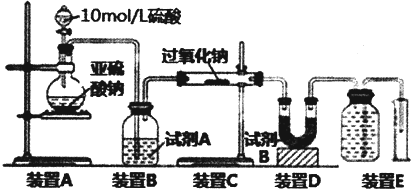
8. 乙酸丁酯沸点、溶解性如下表.
乙酸丁酯沸点、溶解性如下表.
某研究行学习小组设计实验制取乙酸丁酯的方案,其主要步骤如下:
①在三颈瓶中d中加入按体积比1:4:4的比例配制浓硫酸、1-丁醇和乙酸的混合溶液.
②控制115-125℃均匀加热装有混合液的三颈瓶5-10min.
③待锥形瓶e收集到一定量的产物后停止加热,撤去锥形瓶e并用力振荡,然后静置待分层.
④分离出乙酸丁酯层,洗涤,干燥.
根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为:先加入丁醇,然后边摇动试管边慢慢加入浓硫酸,再加乙酸;写出制取乙酸丁酯的化学方程式:CH3COOH+CH3CH2OH $→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(2)上述实验中饱和碳酸钠溶液的作用是BC(填序号);
A.中和乙酸和1-丁醇
B.中和乙酸并吸收部分1-丁醇
C.乙酸丁酯在饱和碳酸钠溶液中的溶解度比在水中更小
D.加速酯的生成,提高其产率
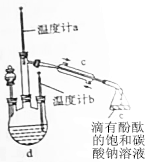
(3)当温度计a(填写“a”或“b”)的温度读数达到126.3℃时,开始收集产品乙酸丁酯.
(4)指出步骤③所观察到的现象:在浅红色碳酸钠溶液层上方有无色液体出现,闻到香味,振荡后碳酸钠溶液层红色变浅;分离处乙酸丁酯后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去(填名称)碳酸钠、乙醇杂质;为了干燥乙酸丁酯可选用的干燥剂为(填序号)B.
A.五氧化二磷 B.无水硫酸钠
C.碱石灰 D.氢氧化钠固体.
 乙酸丁酯沸点、溶解性如下表.
乙酸丁酯沸点、溶解性如下表.| 物质 | 乙酸 | 1-丁醇 | 乙酸丁酯 | 90%浓硫酸 |
| 沸点 | 117.9℃ | 117.2℃ | 126.3℃ | 338.0℃ |
| 溶解性 | 溶于水和有机溶剂 | 溶于水和有机溶剂 | 微溶于水,溶于有机溶剂 | 与水混溶 |
①在三颈瓶中d中加入按体积比1:4:4的比例配制浓硫酸、1-丁醇和乙酸的混合溶液.
②控制115-125℃均匀加热装有混合液的三颈瓶5-10min.
③待锥形瓶e收集到一定量的产物后停止加热,撤去锥形瓶e并用力振荡,然后静置待分层.
④分离出乙酸丁酯层,洗涤,干燥.
根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为:先加入丁醇,然后边摇动试管边慢慢加入浓硫酸,再加乙酸;写出制取乙酸丁酯的化学方程式:CH3COOH+CH3CH2OH $→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(2)上述实验中饱和碳酸钠溶液的作用是BC(填序号);
A.中和乙酸和1-丁醇
B.中和乙酸并吸收部分1-丁醇
C.乙酸丁酯在饱和碳酸钠溶液中的溶解度比在水中更小
D.加速酯的生成,提高其产率
(3)当温度计a(填写“a”或“b”)的温度读数达到126.3℃时,开始收集产品乙酸丁酯.
(4)指出步骤③所观察到的现象:在浅红色碳酸钠溶液层上方有无色液体出现,闻到香味,振荡后碳酸钠溶液层红色变浅;分离处乙酸丁酯后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去(填名称)碳酸钠、乙醇杂质;为了干燥乙酸丁酯可选用的干燥剂为(填序号)B.
A.五氧化二磷 B.无水硫酸钠
C.碱石灰 D.氢氧化钠固体.