题目内容
5.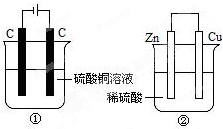 如图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole-,若不考虑溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole-,若不考虑溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积①=② | |
| B. | 溶液的pH变化:①减小②增大 | |
| C. | 电极上析出固体质量①<② | |
| D. | 电极反应式:①中阳极:Cu2++2e-═Cu②中负极Zn-2e-═Zn2+ |
分析 A、根据转移电子的量可以计算①的阳极和②的正极产生气体的量;
B、①相当于电解氯化铜本身,②相当于锌和硫酸中的氢离子反应;
C、①中的两个电极上均析出物质,②中只有正极析出物质,根据转移电子的量可以计算均析出物质的质量;
D、原电池的负极是金属失电子的过程,电解池的阳极是惰性电极时,则阴离子在该极失电子.
解答 解:A、①的阳极反应:4OH--4e-=2H2O+O2↑,导线中通过0.02mol电子时,产生氧气的体积V=nVm=0.005mol×22.4L/mol=0.0112L,②中的正极反应为:2H++2e-=H2↑,导线中通过0.02mol电子时,产生氢气的体积V=nVm=0.01mol×22.4L/mol=0.0224L,所以产生气体的体积:①<②,故A错误;
B、①相当于电解硫酸铜,电解生成硫酸,溶液的pH减小,②相当于锌和硫酸中的氢离子反应,所以氢离子减少,酸性减弱,所以pH增大,故B正确;
C、①的阳极反应:4OH--4e-=2H2O+O2↑,导线中通过0.02mol电子时,产生氧气的质量m=nM=0.005mol×32g/mol=0.16g,②中的正极反应为:2H++2e-=H2↑,导线中通过0.02mol电子时,产生氢气的质量m=nM═nVm=0.01mol×2g/mol=0.02g,所以②电极上析出物质的质量为0.02g,①>②,故C错误;
D、②中负极:Zn-2e-=Zn2+,①中阳极:4OH--4e-=2H2O+O2↑,故D错误.
故选B.
点评 本题综合考查电解池和原电池知识,注意把握电化学工作原理,侧重于学生的分析能力的考查,有利于培养学生的良好的科学素养,难度中等.

练习册系列答案
相关题目
20.下列实验过程中没有沉淀出现的是( )
| A. | 向常温时的饱和碳酸钠溶液中通入足量CO2气体 | |
| B. | 向硅酸钠溶液中通入氯化氢气体 | |
| C. | 向氯化钙和盐酸的混合溶液中通入SO2气体 | |
| D. | 向硝酸银溶液中通入氯气 |
16.下列说法正确的是( )
①生活中使用的漂白粉和肥皂都是混合物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤NaHCO3是发酵粉主要成分之一,Na2CO3可冶疗胃酸过多.
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物.
①生活中使用的漂白粉和肥皂都是混合物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤NaHCO3是发酵粉主要成分之一,Na2CO3可冶疗胃酸过多.
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物.
| A. | ①②③⑤ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①②④⑥ |
20.观察下列几个装置示意图,有关叙述不正确的是( )


| A. | 装置①中阴极上析出红色固体 | |
| B. | 装置②的待镀铁制品应与电源负极相连 | |
| C. | 装置③中a为负极,发生的电极反应式为H2+2OH-+2e-═2H2O | |
| D. | 装置④中在阴极可以得到氢气和氢氧化钠,离子交换膜可选用阳离子交换膜 |
10.下列热化学方程式或说法正确的是( )
| A. | 甲烷的燃烧热为890.3 kJmor-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+202 (g)═C02 (g)+2H20(g)△H=-890.3kJ mol-1 | |
| B. | 500 V、30MPa下,将0.5molN2和1.5 molH2置于密闭的容器中充分反应生成 NH3(g),放热19.3kJ,其热化学方程式为 N2(g)+3H2 (g)$?_{500℃、30Mp}^{催化剂}$2NH3(g)△H=-38.6 kJmol-1 | |
| C. | 同温同压下,等物质的量的H2与足量的C12在光照和点燃条件下充分反应,所产生的热量相同 | |
| D. | 已知中和热为57.3 kJ/mol,则稀硫酸与氢氧化钡溶液反应的热化学方程式为 2H+(aq)+SO42-(aq)+Ba2+(aq)+20H-(aq)=BaS04 (s)+2H20(l)△H=-57.3kJ/mol |
15.下列叙述中正确的是( )
| A. | 硝酸的摩尔质量是63 g | |
| B. | 1 mol CO的质量是28 g | |
| C. | 4 g氢气对应的摩尔质量是2 g氢气对应的摩尔质量的2倍 | |
| D. | 铁的摩尔质量在数值上等于铁原子的相对原子质量 |
