题目内容
6.2015年,我国科学家屠呦呦因在青蒿素发现和治疗中的贡献,获得了诺贝尔生理学或医学奖.由植物黄花蒿叶中提取的青蒿素还可合成用于抗氯喹恶性疟及凶险型疟疾的蒿甲醚,其合成路线如下: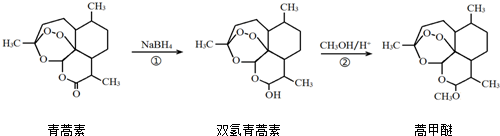
下列说法正确的是( )
| A. | 青蒿素的分子式是C15H21O4 | |
| B. | 青蒿素在NaOH溶液中可以发生水解反应 | |
| C. | 反应②有H2O生成 | |
| D. | 反应①氧化反应 |
分析 A.根据结构简式确定分子式;
B.青蒿素中含有酯基和醚键,具有酯和醚的性质;
C.反应②发生取代反应;
D.反应①发生还原反应.
解答 解:A.根据结构简式知,青蒿素分子式为C15H22O5,故A错误;
B.青蒿素中含有酯基和醚键,具有酯和醚的性质,酯基能发生水解反应,故B正确;
C.反应②为双氢青蒿素和甲醚发生取代反应生成蒿甲醚和水,故C正确;
D.反应①发生还原反应,羰基与氢气发生加成,为还原反应,故D错误.
故选BC.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查反应类型、化学键及酯的性质,题目难度不大.

练习册系列答案
相关题目
14.下表中实验操作、现象和所得出的结论均正确的是
( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将KI和FeCl3溶液在试管中混合后,滴加KSCN溶液 | 溶液变红色 | 氧化性:Fe2+>I2 |
| B | 少量的乙烯通入pH=3的溴水中 | 溴水褪色,pH基本不变 | 两者发生的加成反应 |
| C | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 溶液中一定无NH4+ |
| D | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HA酸性比HB强 |
| A. | A | B. | B | C. | C | D. | D |
1.下列物质的检验,其结论一定正确的是( )
| A. | 向某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有SO42- | |
| B. | 向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32-或SO32- | |
| C. | 取少量久置的Na2SO3样品于试管中加水溶解,再加盐酸酸化,然后加BaCl2溶液,若加盐酸有气体产生,加BaCl2有白色沉淀产生,说明Na2SO3样品已部分被氧化 | |
| D. | 将某气体通入品红溶液中,品红溶液褪色,该气体一定是SO2 |
11.硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:
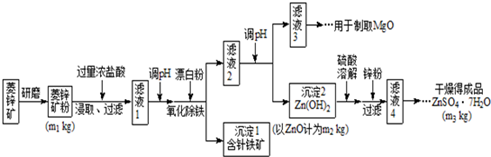
(1)将菱锌矿研磨成粉的目的是增大反应物接触面积,使反应更加充分.
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是FeO(OH).
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4.
(4)工业上从“滤液3”制取MgO过程中,最合适的反应物是B(选填序号).
A、大理石粉 B、石灰乳 C、纯碱溶液 D、烧碱溶液
“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤,洗涤,干燥.
(5)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于$\frac{125{m}_{2}}{{m}_{1}}$.

(1)将菱锌矿研磨成粉的目的是增大反应物接触面积,使反应更加充分.
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是FeO(OH).
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4.
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
A、大理石粉 B、石灰乳 C、纯碱溶液 D、烧碱溶液
“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤,洗涤,干燥.
(5)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于$\frac{125{m}_{2}}{{m}_{1}}$.
18.下列关于煤和石油的说法中正确的是( )
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 石油分馏和煤干馏都是物理变化 | |
| C. | 煤干馏可以得到甲烷、苯和氨等重要化工原料 | |
| D. | 通过煤的液化得到水煤气 |
19.几位同学想用实验的方法,通过自己的亲自观察证明这样一个事实:氯气通入水中能发生反应,但没有全部转化为HClO和HCl.你认为下列相关说法正确的是( )
| A. | 向新制的氯水中加KI?淀粉溶液即可证明 | |
| B. | 向久置失效的氯水中加KI?淀粉溶液即可证明 | |
| C. | 直接观察氯水溶液仍显黄绿色即可说明,不需进一步实验 | |
| D. | 用实验证明干燥的氯气不能使干燥的有色布条褪色,能使湿润的有色布条褪色 |
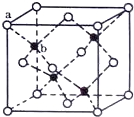 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性