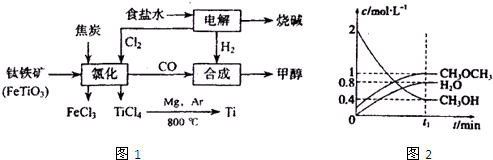
题目内容
 实验室用如图装置制取乙酸乙酯.
实验室用如图装置制取乙酸乙酯.(1)加热前在大试管中加入几粒碎瓷片的作用是
(2)导气管不能插入饱和Na2CO3溶液液面以下是为了
(3)实验室制取乙酸乙酯的化学反应方程式为:
(4)饱和Na2CO3溶液的作用是
考点:乙酸乙酯的制取
专题:实验题
分析:(1)液体加热要加碎瓷片,防止暴沸;
(2)乙酸、乙醇易溶于饱和碳酸钠溶液,导管不能伸入液面是为了防止倒吸;
(3)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(4)饱和碳酸钠溶液与乙酸反应除去乙酸、溶解乙醇,同时降低乙酸乙酯的溶解度,便于分层.
(2)乙酸、乙醇易溶于饱和碳酸钠溶液,导管不能伸入液面是为了防止倒吸;
(3)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(4)饱和碳酸钠溶液与乙酸反应除去乙酸、溶解乙醇,同时降低乙酸乙酯的溶解度,便于分层.
解答:
解答:(1)液体乙酸乙醇沸点低,加热要加碎瓷片,防止暴沸,
故答案为:防止暴沸;
(2)乙酸、乙醇易溶于饱和碳酸钠溶液,导管不能伸入液面是为了防止倒吸,
故答案为:防止倒吸;
(3)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,化学方程式为:CH3COOH+C2H5OH
CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH
CH3COOC2H5+H2O;
(4))制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度.
故答案为:防止暴沸;
(2)乙酸、乙醇易溶于饱和碳酸钠溶液,导管不能伸入液面是为了防止倒吸,
故答案为:防止倒吸;
(3)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,化学方程式为:CH3COOH+C2H5OH
| 浓H2SO4 |
| △ |
故答案为:CH3COOH+C2H5OH
| 浓H2SO4 |
| △ |
(4))制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度.
点评:本题考查了乙酸乙酯的制备,注意把握乙酸乙酯的制备原理和实验方法,把握乙酸乙酯与乙酸、乙醇性质的区别,题目难度不大.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA |
| B、常温常压下,16g14CH4所含中子数目为8NA |
| C、常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA |
| D、标准状况下,22.4L空气含有NA个单质分子 |
将过量的CO2通入下列溶液中,最终会出现浑浊的是( )
| A、CaCl2溶液 |
| B、NaAlO2溶液 |
| C、Na2CO3溶液 |
| D、水玻璃 |
下图所示的实验装置不能完成实验目的是( )
A、 证明非金属性强弱:S>C>Si |
B、 制备少量氧气并控制反应 |
C、 制备并收集少量NO气体 |
D、 量取0.10 mol?L-11KOH溶液20.00 mL |
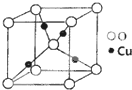 某催化剂中含有的活性组分为Ni、Cu和Zn的化合物,可用于二氧化碳加氢制取甲醚.甲醚是乙醇的同分异构体,其熔点-141.5℃,沸点-24.9℃,在加热条件下可分解成甲烷、乙烷、甲醛等.
某催化剂中含有的活性组分为Ni、Cu和Zn的化合物,可用于二氧化碳加氢制取甲醚.甲醚是乙醇的同分异构体,其熔点-141.5℃,沸点-24.9℃,在加热条件下可分解成甲烷、乙烷、甲醛等.