��Ŀ����
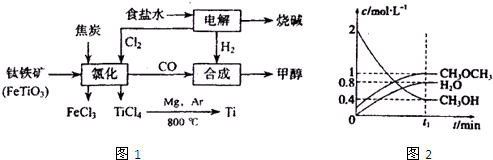
�ѣ�Ti������Ϊ��������֮��ĵ���������Ҳ����˵21�������ѵ����ͣ����ڵؿ��еĺ��������٣����ѵ�ұ��������δ���ͻ�ƣ�Ŀǰ��ֻ���ڼ��������ͼ1��ʾ�����ѳ����ȼ�ͼ״�����ɲ�ҵ���ɴ�������Դ�����ʣ����ٻ�����Ⱦ��
����д���пհף�
��l���ö��Ե缫���2Lʳ��ˮʱ���ܷ�Ӧ�����ӷ���ʽ ���������ϲ���224mL���壨��״����ʱ��������Һ��pH= ��������ǰ����Һ������䣬ʳ��ˮ��������
��2��д���������������Ȼ��õ����Ȼ��ѵĻ�ѧ����ʽ ������ʾ��FeTiO3��TiΪ+4�ۣ�
��3����Ӧ2Mg+TiCl4
2MgCl2+Ti��Ar������������ ��
��4����������һ����Ҫ�����ȼ�ϣ�����ͨ���״����Ӽ���ˮ�Ƶã�2CH3OH��g��?CH3OCH3��g��+H2O��g����H=-23.5kJ/mol
T1��ʱ���ں����ܱ������н�������ƽ�⣬��ϵ�и����Ũ����ʱ��仯��ͼ2��ʾ��
��T1��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ ��
����ͬ�����£����ı���ʼŨ�ȣ�ijʱ�̸����Ũ������Ϊ��c��CH3OH��=0.4mol/L��c��H2O��=0.6mol/L��c��CH3OCH3��=1.2mol/L����ʱ�����淴�����ʵĴ�С��v�� v�棨���������������=������
��5����������ҵ���У��ϳ�192�ּ״�����������ⲹ��H2 �֣��������������������ʵ��κ���ʧ����

����д���пհף�
��l���ö��Ե缫���2Lʳ��ˮʱ���ܷ�Ӧ�����ӷ���ʽ
��2��д���������������Ȼ��õ����Ȼ��ѵĻ�ѧ����ʽ
��3����Ӧ2Mg+TiCl4
| ||
��4����������һ����Ҫ�����ȼ�ϣ�����ͨ���״����Ӽ���ˮ�Ƶã�2CH3OH��g��?CH3OCH3��g��+H2O��g����H=-23.5kJ/mol
T1��ʱ���ں����ܱ������н�������ƽ�⣬��ϵ�и����Ũ����ʱ��仯��ͼ2��ʾ��
��T1��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ
����ͬ�����£����ı���ʼŨ�ȣ�ijʱ�̸����Ũ������Ϊ��c��CH3OH��=0.4mol/L��c��H2O��=0.6mol/L��c��CH3OCH3��=1.2mol/L����ʱ�����淴�����ʵĴ�С��v��
��5����������ҵ���У��ϳ�192�ּ״�����������ⲹ��H2
���㣺���ʷ�����ᴿ�ķ����ͻ��������ۺ�Ӧ��,��ѧƽ���Ӱ������,���ʵ�����Ũ����ʱ��ı仯����,��������Ԫ�صĵ��ʼ��仯������ۺ�Ӧ��
ר�⣺ʵ�������,�����������������
��������1�����ʳ��ˮ����NaOH��H2��Cl2���Դ���д���ӷ���ʽ�����ݷ���ʽ���м���pH��
��2���������Ȼ��õ����Ȼ��ѡ��Ȼ�����һ����̼������ԭ���غ���ƽд����
��3��Mg��Ti���н�ǿ��ԭ�ԣ��ڸ����¶��ױ������е�O2������
��4����ƽ�ⳣ������������ƽ��Ũ���ݴη��˻����Է�Ӧ��Ũ���ݴη��˻��õ�����ͼ���еõ�ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽ���ɼ��㣻
�ڼ���ijһʱ��������Ũ���ݴη��˻����Է�Ӧ��Ũ���ݴη��˻���Qc��ƽ�ⳣ���Ƚϵó���Ӧ����
��5������ͼ�����̿�֪������CO��H2����Ӧ���ɼ״�����������Ҫ������������ȥ����������������������������������
��2���������Ȼ��õ����Ȼ��ѡ��Ȼ�����һ����̼������ԭ���غ���ƽд����
��3��Mg��Ti���н�ǿ��ԭ�ԣ��ڸ����¶��ױ������е�O2������
��4����ƽ�ⳣ������������ƽ��Ũ���ݴη��˻����Է�Ӧ��Ũ���ݴη��˻��õ�����ͼ���еõ�ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽ���ɼ��㣻
�ڼ���ijһʱ��������Ũ���ݴη��˻����Է�Ӧ��Ũ���ݴη��˻���Qc��ƽ�ⳣ���Ƚϵó���Ӧ����
��5������ͼ�����̿�֪������CO��H2����Ӧ���ɼ״�����������Ҫ������������ȥ����������������������������������
���
�⣺��1�����ʳ��ˮ����NaOH��H2��Cl2����Ӧ�����ӷ���ʽΪ2Cl-+2H2O
2OH-+H2��+Cl2�������ʱ�����������ӵõ���������������������������Ϊ��
=0.01mol��
2Cl-+2H2O
2OH-+Cl2��+H2����
2mol 1mol
n 0.01mol
n
=0.02mol��c��OH-��=
=0.01mol/L��c��H+��=
=10-12����pH=12��
�ʴ�Ϊ��2Cl-+2H2O
2OH-+Cl2��+H2����12��
��2����ͼʾ��֪�Ȼ�ʱ�ķ�Ӧ��ΪFeTiO3��C��Cl2��������ΪFeCl3��TiCl4��CO���ٸ��ݵ�ʧ���Ӻ�ԭ���غ㼴�ɵó��÷�Ӧ�ķ���ʽΪ��
2FeTiO3+6C+7Cl2
2FeCl3+2TiCl4+6CO��
�ʴ�Ϊ��2FeTiO3+6C+7Cl2
2FeCl3+2TiCl4+6CO��
��3����Ar�����н��е�������Mg��Ti���н�ǿ��ԭ�ԣ��ڸ����¶��ױ������е�O2������
�ʴ�Ϊ��Mg��Ti����ǿ��ԭ�ԣ���Ar�����п��Է�ֹ��������
��4���ٴ�ͼ���֪��ƽ��Ũ��c��CH3OH��=0.4mol/L��c��H2O��=0.25mol/L��c��CH3OCH3��=1mol/L��ƽ�ⳣ��K=
=5��
�ʴ�Ϊ��5��
��Qc=
=4.5��5����ƽ��������Ӧ�����ƶ�������v����v�棬�ʴ�Ϊ������
��5������CO+2H2��CH3OH��CH3OH��CO��
Cl2��
H2����������1 molCH3OH�������ϻ��貹��������2-
����mol=
mol����
gH2��
������192 t CH3OH���貹��H2������Ϊ��
��
=10t��
�ʴ�Ϊ��10��
| ||
| 0.224L |
| 22.4L/mol |
2Cl-+2H2O
| ||
2mol 1mol
n 0.01mol
n
| 2mol��0.01mol |
| 1mol |
| 0.02mol |
| 2L |
| 10-14 |
| 0.01 |
�ʴ�Ϊ��2Cl-+2H2O
| ||
��2����ͼʾ��֪�Ȼ�ʱ�ķ�Ӧ��ΪFeTiO3��C��Cl2��������ΪFeCl3��TiCl4��CO���ٸ��ݵ�ʧ���Ӻ�ԭ���غ㼴�ɵó��÷�Ӧ�ķ���ʽΪ��
2FeTiO3+6C+7Cl2
| ||
�ʴ�Ϊ��2FeTiO3+6C+7Cl2
| ||
��3����Ar�����н��е�������Mg��Ti���н�ǿ��ԭ�ԣ��ڸ����¶��ױ������е�O2������
�ʴ�Ϊ��Mg��Ti����ǿ��ԭ�ԣ���Ar�����п��Է�ֹ��������
��4���ٴ�ͼ���֪��ƽ��Ũ��c��CH3OH��=0.4mol/L��c��H2O��=0.25mol/L��c��CH3OCH3��=1mol/L��ƽ�ⳣ��K=
| 1��0.8 |
| 0��42 |
�ʴ�Ϊ��5��
��Qc=
| 1.2��0.6 |
| 0��42 |
��5������CO+2H2��CH3OH��CH3OH��CO��
| 7 |
| 6 |
| 7 |
| 6 |
| 7 |
| 6 |
| 5 |
| 6 |
| 5 |
| 3 |
������192 t CH3OH���貹��H2������Ϊ��
| 192t |
| 32 |
| 5 |
| 3 |
�ʴ�Ϊ��10��
������������ۺ��Ժ�ǿ�����ط������������������Ŀ��飬�漰��ѧ��Ӧ����ʽ����д����ѧƽ�⡢���ȶ�����ݣ�ע��֪ʶ��Ǩ��Ӧ�ã���ѧ������Ҫ��ϸߣ���Ŀ�ѶȽϴ�

��ϰ��ϵ�д�
�����Ŀ
�ױ� 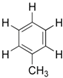 �����ϵ�һ����ԭ�ӱ���3��̼ԭ�ӵ������ȡ�������ܵõ���һԪȡ�����У�������
�����ϵ�һ����ԭ�ӱ���3��̼ԭ�ӵ������ȡ�������ܵõ���һԪȡ�����У�������
 �����ϵ�һ����ԭ�ӱ���3��̼ԭ�ӵ������ȡ�������ܵõ���һԪȡ�����У�������
�����ϵ�һ����ԭ�ӱ���3��̼ԭ�ӵ������ȡ�������ܵõ���һԪȡ�����У�������| A��3�� | B��4�� | C��5�� | D��6�� |
���и��鷴Ӧ�����տ϶��ǰ�ɫ�������ǣ�������
| A��AlCl3��Һ�м��������ˮ |
| B��Al2��SO4��3��Һ�м������KOH��Һ |
| C��FeCl2��Һ�м��������ˮ |
| D��Fe2��SO4��3��Һ�м������KOH��Һ |
ֻ�ý�ͷ�ιܺ��Թܣ����������Լ��Ϳ��������������Һ��Ũ�Ⱦ�Ϊ0.1mol?L-1�����ǣ�������
| A��CaCl2��Na2CO3 |
| B��ϡ�����K2CO3 |
| C��Ba��OH��2��NaHCO3 |
| D��AgNO3������ |


 ʵ��������ͼװ����ȡ����������
ʵ��������ͼװ����ȡ����������